-
设NA为阿伏加德罗常数,下列说法正确的是( )
A、常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
B、在反应KIO3+6HI KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C、标准状况下,11.2 L的SO3所含分子数为0.5NA
D、室温下,8 g甲烷含有共价键数为2NA
难度: 简单查看答案及解析
-
三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )
A、三种气体质量相等 B、三种气体的物质的量之比为16∶2∶1
C、三种气体压强比为16∶2∶1 D、三种气体体积比为1∶8∶16
难度: 简单查看答案及解析
-
下列实验操作会导致实验结果偏低的是( )
①配制100 g 10%的CuSO4溶液,称取10 g CuSO4晶体溶于90 g水中 ②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮 ③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g ④用酸式滴定管量取98%、密度为1.84 g/cm3的浓H2SO4配制200 mL 2 mol/L的稀H2SO4时,先平视后仰视
A、只有① B、只有② C、②③④ D、①③④
难度: 简单查看答案及解析
-
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A、溶质的质量分数为w=
×100%
B、溶质的物质的量浓度c=
mol/L
C、溶液中c(OH-)=
mol/L
D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A、胶体中分散质粒子直径小于1×10-9 m
B、区别胶体与溶液的最简单的方法是丁达尔效应
C、往NaOH溶液中滴入FeCl3溶液立即可制得胶体
D、清晨的阳光穿过茂密的树木枝叶所产生的美丽景象(美丽的光线)是由于胶体粒子对光线反射形成的
难度: 简单查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A、在稀氨水中通入过量CO2:NH3·H2O+CO2 NH4++HCO3-
B、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-________CaSO3↓+2HClO
C、用稀HNO3溶解FeS固体:FeS+2H+________Fe2++H2S↑
D、氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-________CaSO4↓+H2O
难度: 简单查看答案及解析
-
下列各组离子在给定条件下能大量共存的是( )
A、在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B、有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D、在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-
难度: 简单查看答案及解析
-
某溶液中含有HCO3-、SO32-、CO32-、CH3COO4-种阴离子。若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是( )
A、CH3COO- B、SO32- C、CO32- D、HCO3-
难度: 简单查看答案及解析
-
下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
A、①③⑤⑥ B、②④⑤⑥ C、只有⑤ D、只有⑥
难度: 简单查看答案及解析
-
下列氧化还原反应中,水作为氧化剂的是( )
A、CO+H2O(g)
CO2+H2 B、3NO2+H2O
2HNO3+NO
C、2Na2O2+2H2O
4NaOH+O2↑ D、2F2+2H2O
4HF+O2
难度: 简单查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+ 2As+3SnCl62-+6M,关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol
④M为OH- ⑤SnCl62-是氧化产物
A、①③⑤ B、①②④⑤ C.、①②③④ D、①③
难度: 简单查看答案及解析
-
做实验时不小心沾了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+ CO2↑+Mn2++ ,关于此反应的叙述正确的是( )
A、该反应的氧化剂是C2O42- B、该反应右边方框内的产物是OH-
C、该反应电子转移总数是5e- D、配平该反应式后,H+的系数是16
难度: 简单查看答案及解析
-
有关Na2CO3 和NaHCO3的下列叙述中错误的是( )
A、相同质量的NaHCO3和Na2CO3与足量盐酸反应,Na2CO3产生的CO2少
B、将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3 溶液中产生白色沉淀
C、向Na2CO3饱和溶液中通入足量CO2气体会出现浑浊
D、Na2CO3中含少量NaHCO3,可用加热的方法除去
难度: 简单查看答案及解析
-
下列关于Na2O2的说法正确的是( )
A、SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2
B、84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g
C、将Na2O2投入到酚酞试液中,溶液变红
D、Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂
难度: 简单查看答案及解析
-
在相同条件下,总质量为2 g的CO和H2的混合气体,在O2中完全燃烧后全部通过足量的Na2O2固体,则固体质量增加( )
A、2 g B、1 g C、18 g D、无法计算
难度: 简单查看答案及解析
-
在标准状况下,进行甲、乙、丙三组实验:三组各取60 mL同浓度盐酸,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号
甲
乙
丙
合金质量/mg
510
770
918
气体体积/mL
560
672
672
则下列说法正确的是( )
A、甲组和乙组的实验中,盐酸均是过量的
B、盐酸的物质的量浓度为0.8 mol/L
C、合金中镁铝的物质的量之比为1∶1
D、 丙组中铝的物质的量为0.009 mol
难度: 简单查看答案及解析
-
现有AlCl3和MgSO4的混合溶液,向其中不断加入 NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
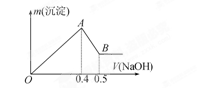
A、1∶1 B、2∶3 C、3∶2 D、6∶1
难度: 简单查看答案及解析
-
下列类比关系正确的是( )
A、AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O反应也生成AlO2-
B、Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C、Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D、Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A、Mg2+、Al3+、Fe2+ B、H+、Mg2+、Al3+
C、H+、Ba2+、Al3+ D、只有Mg2+、Al3+
难度: 简单查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸
A、①② B、①③ C、①④ D、②③
难度: 简单查看答案及解析