-
下列说法中正确的是( )
A.空气能热水器、沼气的利用、乙醇汽油都涉及到生物质能的利用
B.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法
C.钢筋混凝土、玻璃钢、石棉瓦、碳纤维增强陶瓷都是常见的复合材料
D.液化、汽化、风化、熔化等都是物理变化难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次增大的同一短周期元素.X为金属元素,X的单质能与冷水发生剧烈反应;Y的最外层电子数是核外电子层数的2倍,X与Y可形成化合物X2Y;Z单质为共用一对电子对的双原子分子.下列说法不正确的是( )
A.Y2-的还原性较Z-强
B.Y的氢化物与X2Y所含化学键的类型相同
C.YO2与Z2均可作为漂白剂,但起漂白作用的原理不同
D.以石墨为电极电解XZ的水溶液,在阴极附近滴入酚酞可观察到溶液显红色难度: 中等查看答案及解析
-
用NA代表阿伏伽德罗常数.下列说法正确的是( )
A.1molNH3中含有3NA对电子对
B.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5NA
C.将2molSO2和1molO2混合在V2O5存在条件下的密闭容器中,充分反应后分子总数等于2NA
D.VLamol•L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA难度: 中等查看答案及解析
-
下列有关实验操作、现象或实验原理叙述错误的是( )
A.在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度
B.纸层析法分离Fe3+和Cu2+的实验中,点样后的滤纸无需晾干就可将其浸入展开剂中
C.将KNO3和NaCl的混合液加热并浓宿至有晶体析出时,趁热过滤可分离得NaCl晶体
D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全难度: 中等查看答案及解析
-
下列关于有机化合物1和2的说法中正确的是( )
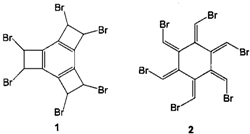
A.有机物1和2互为同分异构体
B.有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应
C.有机物1和2中所有原子均共平面
D.有机物2能使酸性高锰酸钾溶液褪色,而1不能使酸性高锰酸钾溶液褪色难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.H2热值为142.9kJ•g-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ•mol-1
B.Al3+、Cu2+、SO42-、F-能在溶液中大量共存
C.硫酸亚铁溶液在空气中发生氧化反应:4Fe2++O2+4H+=4Fe3++2H2O
D.已知KSP(Ag2SO4)=1.4×10-5,则向100mL0.01mol•L-1的Na2SO4溶液中加入1mL0.01mol•L-1的AgNO3溶液,有白色沉淀生成难度: 中等查看答案及解析
-
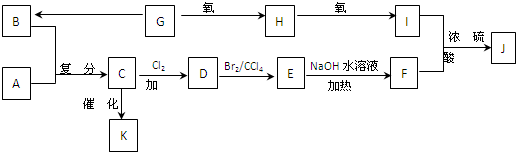
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、NO2-、CO32-,现取三份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,无任何气体产生
(2)第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到xg固体
(3)第三份滴加0.10mol•L-1酸性KMnO4溶液,消耗其体积为VmL
(4)另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是( )
A.原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32-
B.由实验(1)无法推断原混合溶液中是否含有SO42-
C.由实验(2)、(3)可判定原混合溶液中是否含有Fe3+
D.由实验(3)可判定原混合溶液中存在NO2-难度: 中等查看答案及解析