-
下列说法正确的是( )
A.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
B.从形式上看,酯化反应也属于取代反应
C.油脂的相对分子质量都较大,所以属于高分子化合物
D.乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法中正确的是( )
A.2.3gNa被O2完全氧化时,失电子数为0.1NA
B.含有NA个氖原子的氖气在标况下的体积约为11.2L
C.2L1mol/L的醋酸中所含醋酸分子数约为2NA
D.标况下,5.6LCCl4含有的分子数为0.25NA难度: 中等查看答案及解析
-
化学与生活、生产密切相关.下列说法不正确的是( )
A.低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放
B.用稀双氧水清洗伤口可以杀菌消毒
C.“绿色化学”的核心是使原料尽可能全部转化为目标产物
D.高纯度的硅单质广泛用于制作光导纤维难度: 中等查看答案及解析
-
下列实验可行的是( )
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物难度: 中等查看答案及解析
-
下列说法正确的是( )
A.短周期元素X、Y的原子序数相差2,则X、Y不可能处于同一主族
B.可根据氢化物的稳定性和酸性强弱,来判断非金属元素得电子能力强弱
C.非金属元素的最高化合价不超过其元素原子的最外层电子数
D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同难度: 中等查看答案及解析
-
在25℃时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合,下列有关所得溶液的说法中错误的是( )
A.溶液一定呈酸性
B.向反应后的溶液中加入几滴稀盐酸,溶液的pH变化不大
C.溶液中可能存在:c(H+)=c(CH3COO-)+c(OH-)
D.设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:Ka•Kh=Kw难度: 中等查看答案及解析
-
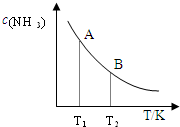
把一块镁铝合金投入到1mol•L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol•L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
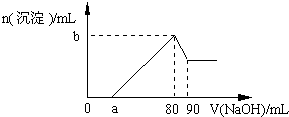
A.盐酸的体积为80mL
B.a的取值范围为0<a<50
C.n(Mg2+)<0.025mol
D.当a值为30时,b值为0.01难度: 中等查看答案及解析