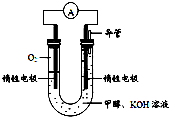
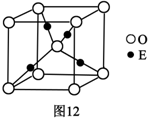
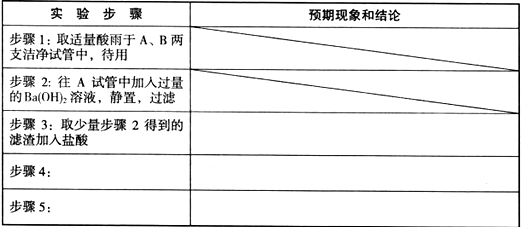
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是:
A.2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA
B.常温下,0.1mol/L HCl溶液中所含的H+个数为0.1NA
C.11.2L 的CO气体与0.5molN2所含的电子数相等
D. 10g H218O中所含的中子数为5NA
难度: 中等查看答案及解析
-
下列叙述正确的是
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行 ⑤Cu与HNO3溶液反应,由于HNO3浓度不同可发生不同的氧化还原反应
A.②③④⑤ B.②③⑤ C.④⑤ D.都正确
难度: 中等查看答案及解析
-
化学与生活密切相关,以下说法不正确的是:
A.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
B.明矾可用于净水;硫酸钡可用于钡餐透视
C.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
D.2010年支援舟曲灾区的生活用品中食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐
难度: 中等查看答案及解析
-
常温下,下列各组离子在溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一
C. pH=12的溶液:
、
、
、Br-
D. 由水电离产生的
的溶液:
、
、
、
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是::
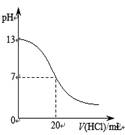
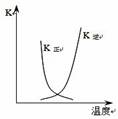
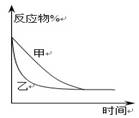
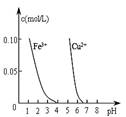
图a 图b 图c 图d
A.图a表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B.图b中曲线表示反应2A(g) + B(g)
2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化
C.图c表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图d,若除去CuSO4溶液中的Fe3+ 可向溶液中加入适量CuO至pH在4左右
难度: 中等查看答案及解析
-
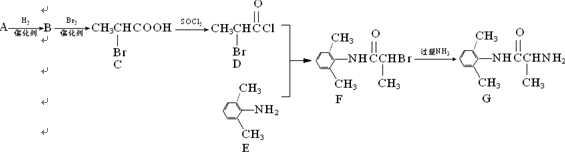
普罗帕酮为广谱高效抗心律失常药。下列说法正确的是:
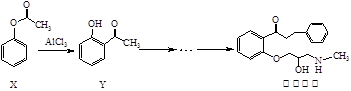
A.可用溴水或FeCl3溶液鉴别X和Y
B.反应物X与中间体Y互为同系物
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应
难度: 中等查看答案及解析
-
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是:
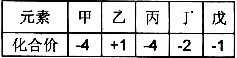
A.乙的常见氧化物只有一种
B.气态氢化物稳定性:丙>丁
C.丙的氧化物能与戊的氢化物的水溶液反应
D.原子半径大小:甲<丙
难度: 中等查看答案及解析