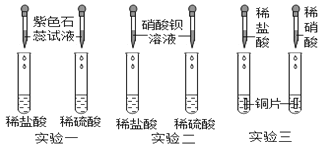
-
下列燃料最清洁的是( )
A. 化石燃料 B. 一氧化碳 C. 氢气 D. 酒精
难度: 简单查看答案及解析
-
下列图标表示物品回收标志的是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
生活中处处有化学。下列说法不正确的是( )
A. 羊毛属于有机合成材料
B. 食用水果和蔬菜能补充维生素
C. 适量的补充碘元素能预防甲状腺疾病
D. NH4HCO3是一种能促进农作物生长的氮肥
难度: 简单查看答案及解析
-
下列关于物质的用途,错误的是( )
A. 金属铜常用于制导线 B. 生石灰可作食品干燥剂
C. 熟石灰可用于改良酸性土壤 D. 甲醛可用于食品防腐
难度: 简单查看答案及解析
-
我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,这是湿法冶金的先驱。反应原理为:Fe+CuSO4===Cu+FeSO4,下列说法正确的是( )
A. 该反应无明显现象
B. 该反应能证明铜的金属活动性比铁强
C. 该反应属于置换反应
D. 该反应前后溶液质量增大
难度: 中等查看答案及解析
-
红豆杉被认为是一种抗癌植物,因从红豆杉中提炼出来的紫杉醇(C47H51NO14)对癌症疗效突出。紫杉醇是一种白色晶体,难溶于水,易溶于有机溶剂。下列说法正确的是( )
A. 紫杉醇是一种氧化物
B. 紫杉醇的相对分子质量为853
C. 直接用水溶解就可从红豆杉中提取紫杉醇
D. 紫杉醇中碳、氢、氮、氧元素的质量比为47:51:1:14
难度: 简单查看答案及解析
-
下列关于燃烧的说法正确的是( )
A. 燃烧是对人类只有利而无害的化学反应
B. 人类获取能量的方式只有通过燃料的燃烧
C. 物质只要与氧气接触且温度足够高就可以燃烧
D. 已知:3Mg+N2
Mg3N2,说明燃烧不一定需要氧气
难度: 中等查看答案及解析
-
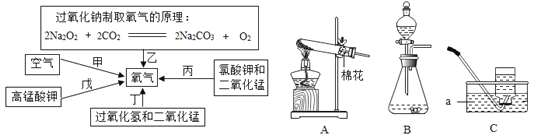
某火力发电厂用石灰石吸收废气中的SO2,部分流程如图。下列说法错误的是( )
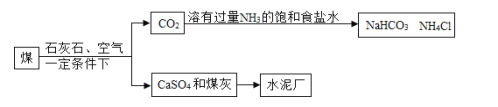
A. 该流程能减少酸雨的形成
B. 饱和食盐水中的NaCl没有参与反应
C. 用CO2制取 NaHCO3,符合低碳理念
D. 用CaSO4和煤灰制水泥,实现废物再利用
难度: 中等查看答案及解析
-
下列实验操作或方法能达到实验目的是( )
选项
实验目的
操作及方法
A
检验NaOH溶液中有Na2CO3
取样,滴加足量氯化钡溶液,观察现象
B
鉴别氮气和二氧化碳气体
用燃着的木条分别插入集气瓶中,观察现象
C
除去二氧化碳中水蒸气
将气体通入装有生石灰的干燥管
D
分离CaCO3和CaCl2固体的混合物
向混合物中滴加足量稀盐酸、过滤
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
物质是变化的,下列物质在一定条件下不能实现一步转化的是( )
A. Mg→MgO→MgCl2 B. Fe2O3→Fe→FeCl2
C. CaCO3→Ca(OH)2→CaSO4 D. S→SO2→SO3
难度: 中等查看答案及解析