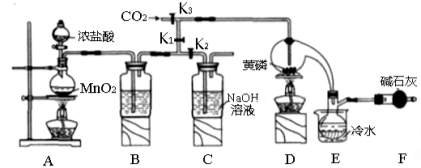
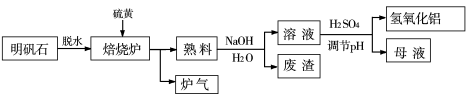
-
化学与生活息息相关.下列说法不正确的是
A.可用淀粉﹣KI试纸和食醋检验真假碘盐
B.用饱和氯化铵溶液可以清洗金属表面的锈迹
C.次氯酸钠溶液是生活中常用的消毒剂
D.经常食用含明矾的食品能中和过多的胃酸
难度: 简单查看答案及解析
-
已知:(1)Al(OH)3的电离方程式为:AlO2- +H++H2O
Al(OH)3
Al3++3OH-
(2)电解熔融AlCl3不能得到金属铝,AlCl3溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
难度: 困难查看答案及解析
-
对H2O的电离平衡不产生影响的微粒是
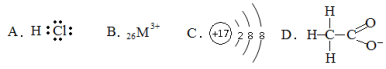
难度: 中等查看答案及解析
-
下列选项中哪一种可与陶瓷、普通玻璃、水泥归为同种类型的材料
A.铝合金 B.高温结构氮化硅陶瓷
C.有机玻璃 D.砖瓦
难度: 中等查看答案及解析
-
关于下图中各装置的叙述不正确的是
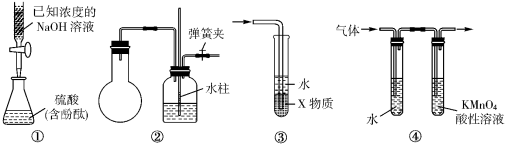
A.装置①是中和滴定法测定硫酸的物质的量浓度
B.装置②中手捂烧瓶(橡胶管已被弹簧夹夹紧),发现导管中有液柱上升并保持稳定,则说明装置不漏气
C.装置③中X若为四氯化碳,可用于吸收氨气和氯化氢,并防止倒吸
D.装置④可用于检验溴乙烷发生消去反应得到的气体中含有乙烯(假定每个装置中吸收完全)
难度: 中等查看答案及解析
-
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
A.在潮湿疏松的碱性土壤中
B.在含铁元素较多的酸性土壤中
C.在干燥致密不透气的土壤中
D.在含碳粒较多,潮湿透气的中性土壤中
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是:

A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B﹥A。
C.图3表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应。
D.图4表示将1.000 mol·L-1氨水滴入20.00 mL1.000 mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32 -
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C.
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42 -
难度: 困难查看答案及解析
-
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH4+)=c(Cl-)
B.若a>b,则c(NH4+)>c(Cl-)
C.若a>b,则c(OH-)>c(H+)
D.若a<b,则c(OH-)<c(H+)
难度: 中等查看答案及解析
-
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,有关说法正确的是
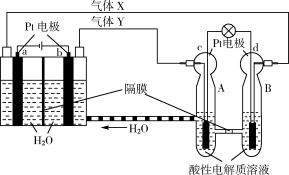
A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e- = 2H2O
难度: 中等查看答案及解析
-
将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物.下列判断错误的是
①MO2具有氧化性 ②白色不溶物X为MSO2
③白色不溶物X为MSO4 ④白色不溶物X为MS.
A.①② B.③④ C.②④ D.①③
难度: 中等查看答案及解析
-
冶炼金属一般有下列四种方法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。古代有:(I)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析,不正确的是
A.Ⅰ,① B.Ⅱ,② C.Ⅲ,③ D.Ⅳ,④
难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物。
能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
难度: 困难查看答案及解析
-
已知可逆反应:X(g)+3Y(g)
2Z(g) ΔH<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1 mol X和 3 mol Y ,在一定条件下达到平衡时放出热量为Q1KJ。在相同条件下,向乙容器中加入2 mol Z,达到平衡时吸收热量Q2KJ ,已知 Q1=3Q2。下列叙述正确的是
A.平衡时甲、乙中Z的体积分数甲>乙
B.平衡时甲中X的转化率为75%
C.达到平衡后,再向乙中加入0.25 mol X,0.75 mol Y和1.5 mol Z,平衡向生成x的方向移动
难度: 困难查看答案及解析