-
下列物质可以使蛋白质变性的是
①福尔马林 ②酒精 ③高锰酸钾溶液 ④硫酸铵 ⑤硫酸铜 ⑥双氧水 ⑦硝酸
A 除④⑦外 B 除③⑥外 C ①②⑤ D 除④外
难度: 简单查看答案及解析
-
用括号中的试剂和方法除去各组物质中的少量杂质,正确的是
A.苯中的甲苯(酸化高锰酸钾溶液 分液) B.乙醇中的水(无水硫酸铜 干燥)
C.乙醇中的乙酸(NaOH溶液 分液) D.溴乙烷中的乙醇 :(水 分液)
难度: 简单查看答案及解析
-
下列变化不能用勒夏特列原理解释的是
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
难度: 简单查看答案及解析
-
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
难度: 简单查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水(l)和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-=2H2O(l)
C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-=4OH-(aq)
难度: 简单查看答案及解析
-
下列分子式只能表示一种物质的是
A.C3H7Cl B.CH2Cl2 C.C7H8O D.C2H4O2
难度: 简单查看答案及解析
-
下列各化合物的命名中正确的是
A.CH2=CH-CH=CH2 1,3—二丁烯 B.CH3 –O –CH3 乙醚
C. 3―丁醇 D. 2―甲基丁烷
难度: 简单查看答案及解析
-
下列各组物质中,一定属于同系物的是
A.甲酸、硬脂酸 B.CH4O、C2H6O
C.
D.CH3OH、CH2(OH)CH2OH
难度: 简单查看答案及解析
-
某温度下,N2O4(g)
2 NO2(g);△H>0。在密闭容器中达到平衡,下列说法不正确的是
A.加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动
B.保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向动
C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时颜色变深
难度: 简单查看答案及解析
-
在FeCl3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在:
FeCl3+3KSCN
Fe(SCN)3+3KCl。已知Fe(SCN)3呈红色,则在该平衡体系中加入少量KCl晶体后(忽略溶液体积的变化),红色将
A.变深 B.变浅 C.不变 D.无法确定
难度: 简单查看答案及解析
-
在容积可变的密闭容器中,2mo1N2和8mo1H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
A.5% B.10% C.15% D.20%
难度: 简单查看答案及解析
-
在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
A.1.0体积的N2和3.0体积的H2
B.2.0体积的N2、6.0体积的H2和4.0体积的NH3
C.2.0体积的NH3
D.4.0体积的NH3和1.0体积的H2
难度: 简单查看答案及解析
-
下列物质水解时,最难断裂的化学键是
难度: 简单查看答案及解析
-
下列各组烃的混合物,只要总质量一定,无论按什么比例混合,完全燃烧后生成的CO2和H2O都是恒量的是
A.C2H2、C6H6 B.C2H4、C4H6 C.C3H8、C3H6 D.C2H4、C2H2
难度: 简单查看答案及解析
-
甲酸、甲酸酯、甲酸钠、醋酸、甘油、福尔马林、葡萄糖、淀粉、多肽、蛋白质物质中,一定条件下能与新制的氢氧化铜反应的物质有
A.8种 B.9种 C.10种 D.11种
难度: 简单查看答案及解析
-
邻羟基苯甲酸,俗名水杨酸,结构简式如左下所示,它与物质A的水溶液反应生成化学式为C7H5O3Na的钠盐,A可能是下列中的
A.Na B.NaOH
C.Na2CO3 D.NaHCO3
难度: 简单查看答案及解析
-
下图表示4-溴-1-环己醇所发生的4个不同反应。其中产物只含有一种官能团的反应是 ( )
A.②③ B.①④
C.①②④ D.①②③④
难度: 简单查看答案及解析
-
芳香族化合物X(C8H8O4)的苯环上的一卤代物只有两种,X不能与NaHCO3(aq)反应,而等物质的量的X分别与足量的Na和NaOH(aq)充分反应后消耗n(Na)︰n(NaOH)=2︰3,则X必定含有 ( )
A.-COOH B.—CHO C.醇羟基 D.酚羟基
难度: 简单查看答案及解析
-
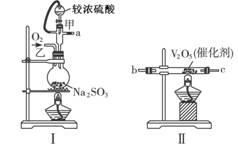
右图是实验室制溴苯的装置图,下列说法正确的是( )
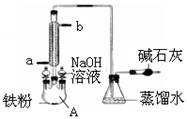
A.左侧的分液漏斗中加入的是苯和溴水
B.仪器A的名称叫蒸馏烧瓶
C.锥形瓶中的导管口出现大量白雾
D.碱石灰作用是防止空气中水蒸气进入反应体系
难度: 简单查看答案及解析
-
某羧酸衍生物A,分子式为C5H10O2,A、B、C、D、 E 五种物质的转化关系如右图所示,已知D不与Na2CO3溶液反应,C和E均能发生银镜反应,则A可能的结构简式有:
A、2种 B、3种 C、4种 D、5种
难度: 简单查看答案及解析
-
可以判定某酸(HA)是强电解质的事实是( )
A.该酸加热至沸腾不分解 B.该酸与CaCO3反应放出CO2
C.该酸可以溶解Cu(OH)2 D.0.01 mol/L该酸的pH=2
难度: 简单查看答案及解析
-
室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
难度: 简单查看答案及解析
-
下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④ B.仅②④ C.仅①② D.全部
难度: 简单查看答案及解析
-
第一次用无机物制备有机物尿素,开辟人工合成有机物先河的科学家是 ( )
A.瑞典的贝采利乌斯 B. 德国的凯库勒
C.德国的李比希 D. 德国的维勒
难度: 简单查看答案及解析