-
热还原法冶炼金属的反应一定是( )
A.置换反应 B.分解反应 C.复分解反应 D.氧化还原反应
难度: 简单查看答案及解析
-
下列装置中能构成原电池产生电流的是( )
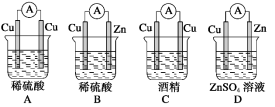
难度: 简单查看答案及解析
-
下列物质与水混合后静置,不出现分层的是( )
A.三氯甲烷 B.乙醇 C.苯 D.四氯化碳
难度: 简单查看答案及解析
-
中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
A.火法炼铜
B.粘土制陶瓷
C.树皮造纸
D.打磨磁石制指南针




难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+
NO(g)达到平衡,正反应速率随时间变化的示意图如右所示。由图可得出的正确结论是( )
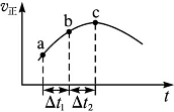
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
难度: 困难查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A.乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应。
B.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.乙烯和苯都能发生加成反应
难度: 中等查看答案及解析
-
下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都
是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.
②③⑤⑥⑦
难度: 困难查看答案及解析
-
有五组同族元素的物质,在101.3kPa时测定它们的沸点(℃)如下表所示:
①
He-268.8
(a)-249.5
Ar-185.8
Kr151.7
②
F2-187.0
Cl2-33.6
(b)58.7
I2184.0
③
(c)19.4
HCl-84.0
HBr-67.0
HI-35.3
④
H2O100.0
H2S-60.0
(d)-42.0
H2Te-1.8[
⑤
CH4-161.0
SiH4-112.0
GeH4-90.0
(e)-52.0
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
C.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
D.上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高
难度: 困难查看答案及解析
-
下列物质中,既有离子键,又有极性共价键的是( )
A.Na
2O2 B.CaCl2 C.KOH D.H2SO4
难度: 简单查看答案及解析
-
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式表示的是
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
难度: 中等查看答案及解析
-
下列水溶液一定呈中性的是
A.由非电
解质溶于水得到的溶液
B.[H+]、[OH–]均为5.0×10–7 mol·L–1的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将pH=9的烧碱溶液稀释100倍所得到的溶液
难度: 中等查看答案及解析
-
下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是( )
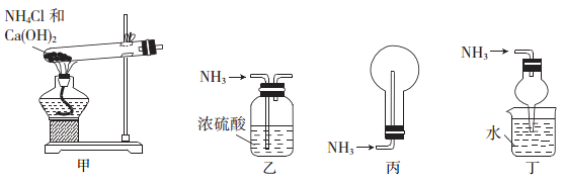
A.用装置甲制备氨气 B.用装置乙除去氨气中
少量水
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
难度: 中等查看答案及解析
-
颠茄酸酯(
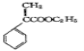 )是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是
)是一种用于胃肠道平滑肌痉挛及溃疡病的辅助治疗药物,下列说法正确的是A.不能使酸性KMnO4溶液褪色
B.1mol颠茄酸酯最多与4molBr2发生加成反应
C.能与NaHCO3溶液反应
D.能与NaOH溶液反应
难度: 中等查看答案及解析
-
短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a–b),L层电子数为(a+b)。则甲、乙两元素形成的化合物具有的性质是( )
A. 与水反应 B. 与氢氧化钠溶液反应
C. 与硫酸反应 D. 与前三种物质均能反应
难度: 中等查看答案及解析
-
下列说法正确的是
A.将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间
后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生
B.新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯(必要时可加热)
C.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
D.向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成 ,说明淀粉未开始水解
难度: 中等查看答案及解析
-
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的相对原子质量是:
A. 24 B.74 C.148 D.40
难度: 中等查看答案及解析
-
分子式为C7H16的烷烃中,在结构简式中含有3个甲基的同分异构体数目是
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述中正确的是
A.化学反应速率的关系是2v逆(NH3)=3v正(H2O)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时4v正(O2)=5v逆(NO)
难度: 中等查看答案及解析
-
用FeCl3溶液无法区别的一组试剂是 ( )
A.KSCN溶液、KCl溶液 B.NaOH溶液、NaCl溶液
C.稀盐酸、稀硝酸 D.AgNO3溶液、稀HNO3
难度: 中等查看答案及解析
-
铁与水蒸气反应的下列事实中能说明发生化学反应的是:
A.试管中最终固体为黑色 B.棉花的湿度减小
C.有肥皂泡产生 D.点燃肥皂泡有轻微爆鸣声
难度: 中等查看答案及解析
-
肼(H2N﹣NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1molN﹣H键所需的能量(kJ)是( )
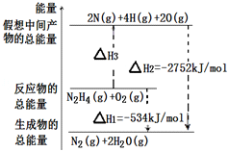
A.194 B.391 C.516 D.658
难度: 困难查看答案及解析
-
下列说法正确的是
A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大
C.1 L 1 mol•L―1的NaClO溶液中含有ClO―的数目为6.02×1023
D.相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu
B.盐酸与饱和的澄清石灰水反应:H++OH-═H2O
C.碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O
D.稀硫酸滴在铜片上:Cu+2H+==Cu2++H2↑
难度: 中等查看答案及解析
-
某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。下列有关评价正确的是
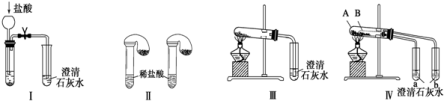
A.根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳
酸钠和碳酸氢钠固体
B.在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体
C.与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
D.若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠
难度: 困难查看答案及解析
-
优质的锂碘电池可用于心脏起搏器延续患者的生命,它的正极是聚2-乙烯吡啶和I2的复合物,电解质是固态薄膜状的碘化锂,电池的总反应为:2Li+P2VP· nI2=P2VP·(n-1)I2+2LiI,则下列说法正确的
A.该电池的电势低,使用寿命比较短
B.电池工作时,碘离子移向P2VP一极
C.聚2-乙烯吡啶的复合物与有机物性质相似,因此不会导电
D
.正极的反应为:P2VP·nI2+2Li++2e-=P2VP·(n-1)I2+2LiI
难度: 困难查看答案及解析
-
将两种不同物质的量浓度的Na2CO3溶液升高温度溶液中c(CO32-)变化如图所示,下列微粒的物质的量浓度关系正确的是( )
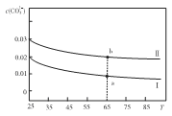
A.将溶液I升高温度,溶液pH减小
B.溶液a比溶液b中
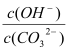 更大
更大C.65℃时,向溶液a中加入1.06gNa2CO3固体,溶解后即为溶液b
D.溶液II一定存在:c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
难度: 困难查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液200 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在5种离子
B.SO42-、NH4+、Fe3+一定存在, Cl-可能不存在
C.Cl-一定存在,且c(Cl-) ≥ 0.2mol/L
D.CO32-、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
下列反应的离子方程式表示正确的是( )
A.H2O2溶液与酸性KMnO4溶液反应:2MnO4﹣+3H2O2+6H+═2Mn2++6H2O+4O2↑
B.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3﹣+8H++6I﹣═3I2+2NO↑+4H2O
C.少量SO2通入碳酸钠溶液中:CO32﹣+SO2═CO2+SO32﹣
D.0.01 mol•L﹣1 NH4Al(SO4)2溶液与0.02 mol•L﹣1 Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3•H2O
难度: 困难查看答案及解析