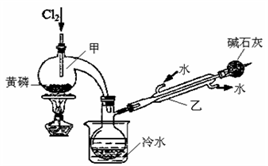
-
明朝《菽园杂记》有海水提取食盐的记载:“烧草为灰,布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋”。该过程中“灰”的作用是( )
A. 萃取 B. 吸附 C. 结晶 D. 蒸发
难度: 简单查看答案及解析
-
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=−98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确的是( )
选项
实验
现象
结论
A
向酸性KMnO4溶液中滴加H2O2溶液至过量
紫色消失
H2O2在该反应中作还原剂
B
溶有SO2的BaCl2溶液中通入气体X
有白色沉淀产生
X一定是Cl2
C
向FeBr2和KSCN混合溶液中滴入少量现制氯水,再滴入CCl4混合振荡、静置
有机相呈红棕色,水相呈无色
Fe2+的还原性大于Br-
D
铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中
铝丝表明变红色
铝可以从铜盐溶液中置换出铜
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A. 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA
B. 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA
C. 常温下,1 L 0.1 mol·L–1 CH3COONa溶液中CH3COO-离子数目为0.1 NA
D. 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L
难度: 中等查看答案及解析
-
以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是 ( )
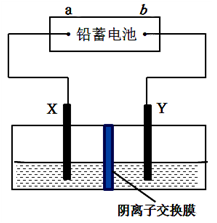
A. a为铅蓄电池的负极 B. 电解过程中SO42-向右侧移动
C. 电解结束时,左侧溶液质量增重8g D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
难度: 困难查看答案及解析
-
分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A. 元素X与氢形成的原子比为1:1的化合物有很多种
B. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D. 元素Z可与元素X形成共价化合物XZ2
难度: 中等查看答案及解析
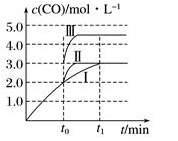
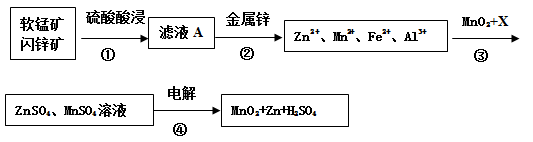
 )的过程如下:
)的过程如下: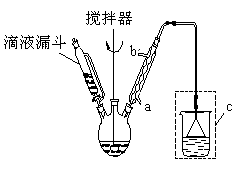
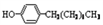 ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。