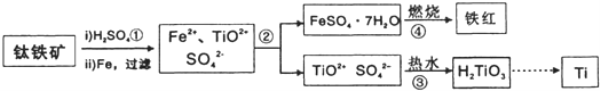
-
化学与生活密切相关,下列说法不正确的是( )
A. 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源
B. “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感
C. 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量
D. 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列判断正确的是( )
A. 常温常压下,22.4 L CO2中含有的CO2分子数小于NA个
B. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1 NA
C. 等物质的量的N2和CO的质量均为28 g
D. 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5NA
难度: 中等查看答案及解析
-
下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
难度: 中等查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的是( )

A. 氧化废液中的溴化氢 B. 分离CCl4层和水层 C. 分离CCl4和液溴 D. 长期贮存液溴
难度: 中等查看答案及解析
-
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A. D>C>A>B B. D>A>B>C
C. D>B>A>C D. B>A>D>C
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
B. 以石墨作电极电解氯化铝溶液:2Cl–+2H2O电解2OH–+H2↑+Cl2↑
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br–+5Cl2=4Fe3++3Br2+10Cl–
D. 向明矾溶液中加人氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
难度: 中等查看答案及解析
-
下列4个坐标图分别表示4个实验过程中某些质量的变化。其中正确的是( )
A
B
C
D
向一定量石灰石
中滴加稀盐酸
向一定量硫酸铜溶液
中不断加入铁粉
向足量盐酸中加
等质量的金属Zn、Fe
向一定量过氧化氢溶液中加入少量二氧化锰
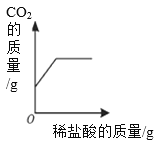
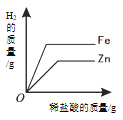
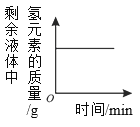
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的是( )
A. Al3+、K+、SO42–、Cl–、AlO2– B. Fe2+、H+、Br–、NO3–、Cl–
C. Na+、K+、SO42–、NO3–、Cl– D. Al3+、Na+、Cl–、SO42–、NO3–
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的( )
①常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
②14.2g 硫酸钠固体中含有0.1NA个硫酸钠分子;
③标准状况下下,11.2L己烷所含的分子数为0.5NA;
④10ml 18mol/L的浓硫酸与足量的镁反应时转移的电子数为 0.18NA
⑤标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.4NA
⑥2克D216O中含有的质子数、中子数、电子数均为NA.
A.①②⑥ B.③④ C.①⑤⑥ D.④⑤⑥
难度: 简单查看答案及解析
-
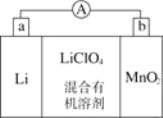
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )
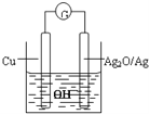
A. 装置中电流方向由Cu经导线到Ag2O
B. 测量原理示意图中,Ag2O为负极
C. 负极的电极反应式为:2Cu+2OH–-2e–=Cu2O+H2O
D. 电池工作时,OH–向正极移动
难度: 中等查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
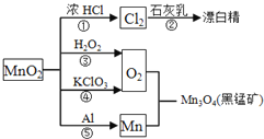
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
难度: 困难查看答案及解析
-
下列实验操作能达到相应目的是( )
编号
实验操作
目的
A
取4 g NaOH固体溶入100 mL水中
配制4 mol/L NaOH溶液
B
向沸水中逐滴加入1~2 mL FeCl3饱和
溶液,搅拌并继续煮沸出现浑浊
制备Fe(OH)3胶体
C
测定等物质的量浓度的盐酸、硝酸的pH
比较Cl、N的非金属性强弱
D
用熔融氧化铝、CCl4做导电性实验
验证两者是离子化合物还是共价化合物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在浓盐酸中HNO2与SnCl2反应的离子方程式为3SnCl2+12Cl–+2HNO2+6H+=N2+3SnClxy–+4H2O,关于该反应的说法都正确的是( )
①氧化剂是HNO2;②还原性:Cl–>N2;③每生成2.8 g N2,还原剂失去的电子为0.6 mol;
④x为6,y为2;⑤SnClxy–是氧化产物
A. ①③ B. ①③④⑤ C. ①②③④ D. ①④⑤
难度: 中等查看答案及解析
-
下列示意图与对应的反应情况符合的是( )
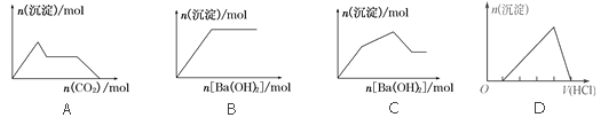
A. 向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B. 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C. 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D. 向含有少量氢氧化钠的NaAlO2溶液中逐滴加入盐酸至过量
难度: 中等查看答案及解析
-
pH=1的某溶液X中还含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32–、SO32–、SO42–、Cl–、NO3–中的一种或几种(忽略水的电离及离子的水解),取该溶液进行如下实验:

下列有关推断不正确的是( )
A. 沉淀H为Al(OH)3、BaCO3的混合物
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl–
C. 溶液X中一定含有Al3+、NH4+、Fe2+、SO42–、H+
D. 若溶液X为100 mL,产生的气体A为44.8 mL(标况),则X中c(Fe2+)=0.06 mol·L–1
难度: 困难查看答案及解析
-
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH)。工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),该反应的反应热ΔH为( )
化学键
Si-O
Si-Cl
H-H
H-Cl
Si-Si
Si-C
键能/kJ·mol–1
460
360
436
431
176
347
A. +412 kJ·mol–1 B. -412 kJ·mol–1 C. +236 kJ·mol–1 D. -236 kJ·mol–1
难度: 中等查看答案及解析
-
已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且c(Cl–)/c(ClO–)的值与温度高低有关,当n(NaOH)=a mol时,下列有关说法错误的是( )
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度,反应中转移电子的物质的量n的范围:a/2 mol≤n≤5a/6 mol
D. 某温度下,若反应后c(Cl–)/c(ClO–)=11,则溶液中c(Cl–)/c(ClO3–) =11/2
难度: 中等查看答案及解析
-
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1︰1︰1 时,实际参加反应的FeS 与HNO3的物质的量之比为( )
A. 1︰7 B. 1︰6 C. 2︰11 D. 16︰25
难度: 中等查看答案及解析
-
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入 3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是( )
A. 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
C. 参加反应的金属的总质量9.6 g>m>3.6 g
D. 当金属全部溶解时收集到 NO气体的体积一定为2.24 L
难度: 极难查看答案及解析