-
化学与生产、生活密切相关。下列有关说法正确的是
A. 化学危险品易危害人类,应禁止生产
B. 汽车尾气是目前城市大气污染产生的一个重要来源
C. 氢氧化钠和氢氧化铝都可用于治疗胃酸过多
D. 漂白粉长期放置在空气中不会变质
难度: 简单查看答案及解析
-
下列说法正确的是
A. HNO3是挥发性一元酸
B. Al2O3是金属氧化物、也是碱性氧化物
C. 氧气和臭氧的相互转化是物理变化
D. 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来
难度: 简单查看答案及解析
-
下列有关物质的性质与用途说法不正确的是
A. FeCl3易溶于水,可用作净水剂
B. 硅是半导体材料,纯净的硅是光纤制品的基本原料
C. 浓硫酸能干燥氯气,说明浓硫酸具有吸水性
D. 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
难度: 简单查看答案及解析
-
已知某离子反应为:8Fe2++NO3-+10H+=NH4++8Fe3++3H2O,下列说法不正确的是
A. Fe2+为还原剂,NO3-被还原
B. 消耗l mol氧化剂,转移电子8 mol
C. 氧化产物与还原产物的物质的量之比为1︰8
D. 若把该反应设计为原电池,则负极反应式为 Fe2+-e-=Fe3+
难度: 中等查看答案及解析
-
根据下列实验现象或结果不能证明一元酸HR为弱酸的是
A. HR溶液中滴加紫色石蕊试液,溶液变红色
B. 室温时,NaR溶液的pH大于7
C. HR溶液加入少量NaR固体,溶解后溶液的pH变大
D. 室温时,0.01 mol·L-1的HR溶液pH=4
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 金属钠与水反应:Na+H2O=Na++OH-+H2↑
B. NaHCO3的水解反应:HCO3-+H2O
CO32-+H3O+
C. 铁和稀HNO3反应后溶液pH=1:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
难度: 简单查看答案及解析
-
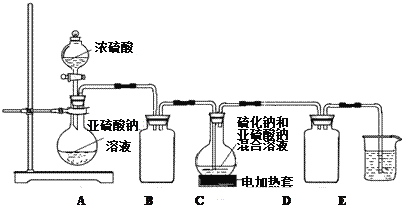
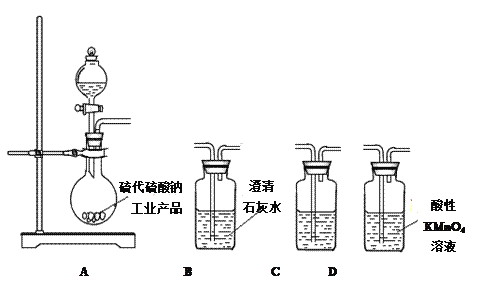
下列有关实验装置,能达到实验目的的是
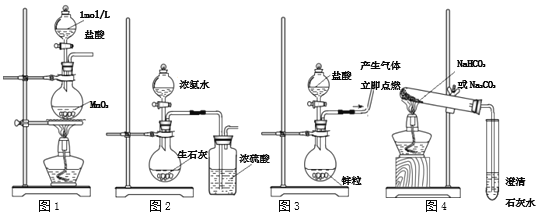
A. 用图1所示装置制取少量Cl2
B. 用图2所示装置制取干燥的NH3
C. 用图3制备并检验H2的可燃性
D. 用图4装置鉴别碳酸钠和碳酸氢钠
难度: 简单查看答案及解析
-
下列有关实验说法正确的是
A. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果∆H偏小
B. 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化
C. 滴定管在装标准溶液前,必须先用待装标准溶液润洗
D. NaHCO3溶液和稀盐酸可以用互滴的方法鉴别
难度: 简单查看答案及解析
-
向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是
A.反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l) 为放热反应
B.CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ∆H=(∆H1+∆H2+∆H3)
C.∆H1>∆H2 ∆H2<∆H3
D.H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则∆H3变小
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得结论正确的是
选项
实验操作和现象
结论
A
用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色
溶液中含有Na+
B
向浓度均为0.1 mol·L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀。
Ksp[Fe(OH)3]<Ksp[Al(OH)3]
C
室温下,用pH试纸测得:0.1 mol·L-1Na2CO3溶液的pH约为11;0.1 mol·L-1NaHCO3溶液的pH约为8。
HCO3-结合H+的能力比CO32-的强
D
用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗得干净
存在可逆过程:
Fe3++Ag
Fe2++Ag+,且溶解度AgCl<Ag2SO4
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的∆H>0
B. 常温下,NH4Cl溶液加水稀释,
不变
C. 向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解
D. 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
难度: 简单查看答案及解析
-
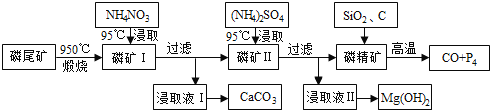
具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
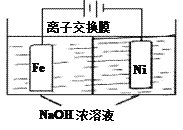
A. 电解一段时间后,阳极室的c(OH-)增大
B. Na+由阴极室移向阳极室
C. 阴极反应式:2H2O+2e-=H2↑+2OH-
D. 电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
难度: 简单查看答案及解析
-
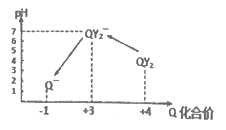
工业上用Fe2(SO4)3酸性溶液处理SO2废气的工艺流程如下,下列说法不正确的是
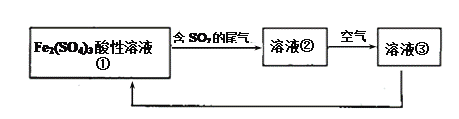
A. 溶液的pH:①>②>③
B. 整个过程中Fe2(SO4)3溶液可以循环利用
C. 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O
D. 向②溶液中滴加KSCN溶液,溶液可能变为血红色
难度: 困难查看答案及解析
-
向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
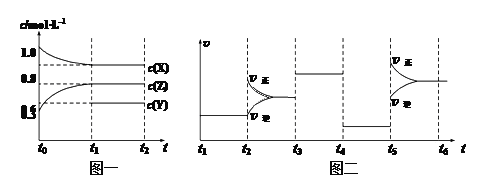
A. Y的起始物质的量为0.5 mol
B. 该反应的化学方程式为:2X(g)+Y(g)
3Z(g) ∆H<0
C. 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D. 反应物X的转化率t6点比t3点高
难度: 简单查看答案及解析
-
常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是
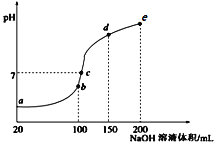
A. b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-)
难度: 简单查看答案及解析