-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质
难度: 中等查看答案及解析
-
下列说法涉及到氧化还原反应的有几种( )
①人工固氮 ②农药波尔多液不能用铁质容器盛放 ③维生素C又称抗坏血酸,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+ ④黑火药爆炸 ⑤铝的表面生成致密氧化膜 ⑥氢氧化钠久置于空气中表面发生潮解 ⑦Fe(OH)3胶体的制备 ⑧氨气的实验室制备 ⑨漂白粉做消毒剂 ⑩铁粉做食品袋内的脱氧剂
A. 6 B. 7 C. 8 D. 9
难度: 中等查看答案及解析
-
下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
所谓合金,就是不同种金属(也包括一些非金属)在熔融状态下形成的一种熔合物,下表为四种金属的熔、沸点,根据以下数据判断其中不能形成合金的是( )
Na
Cu
Al
Fe
熔点(℃)
97.5
1 083
660
1 535
沸点(℃)
883
2 595
2 200
3 000
A. Cu和Na B. Fe和Cu C. Fe和Al D. Al和Na
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 胶体与其它分散系的本质区别是分散质粒子直径的大小在1-100 nm之间
B. 可以利用丁达尔效应区分胶体和溶液
C. 胶体均能发生布朗运动和电泳现象
D. 胶体在一定条件下能稳定存在
难度: 中等查看答案及解析
-
下列化学反应对应的离子方程式书写正确的是( )
A. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B. 碘水中通入适量的SO2:I2+SO2+2H2O=2I-+SO42−+4H+
C. NH4Al(SO4)2溶液中滴加少量的NaOH:NH4++OH-=NH3·H2O
D. 向一定量KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42−+2Ba2++4OH-=AlO2−+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸、浓硫酸反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O;
下列有关叙述正确的是( )
A. 氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B. 反应①中Se是氧化产物,I2是还原产物
C. 反应①中生成0.6mol I2,转移的电子数目为2.4NA
D. 反应②③中等量的Se消耗浓硫酸和浓硝酸中溶质的物质的量之比为2:1
难度: 困难查看答案及解析
-
现有铁粉和Br2物质的量都为n mol充分反应,加水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是( )
A. 当a = 1/3n时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B. 当a = 3/2n时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br-有一半被氧化时,溶液中c(Fe3+): c(Br-):c(Cl-) =1:1:3
D. 当0<a<1/2n时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)
难度: 困难查看答案及解析
-
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是( )
选项
实验目的
玻璃仪器
A.
分离乙醇和乙酸乙酯的混合物
分液漏斗、烧杯
B.
用pH=1的盐酸配制100mL pH=2的盐酸
100mL容量瓶、烧杯、玻璃棒、胶头滴管
C.
用溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱
试管、胶头滴管
D.
用NH4Cl和Ca(OH)2固体制备并收集NH3
酒精灯、烧杯、导管、集气瓶
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L 氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A. NaCl(aq)
NaHCO3(s)
Na2CO3(s)
B. CuCl2
Cu(OH)2
Cu
C. Al
NaAlO2(aq)
NaAlO2(s)
D. MgO(s)
Mg(NO3)2(aq)
Mg(s)
难度: 中等查看答案及解析
-
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
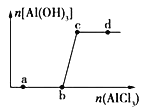
A. a点对应的溶液中:Na+、Fe3+、SO42−、HCO3−
B. b点对应的溶液中:Na+、S2−、SO42−、Cl−
C. c点对应的溶液中:Ag+、Ca2+、NO3−、F−
D. d点对应的溶液中:K+、NH4+、I−、CO32−
难度: 困难查看答案及解析
-
K2Cr2O7溶液中存在平衡:
Cr2O72−(橙色)+H2O
2CrO42−(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
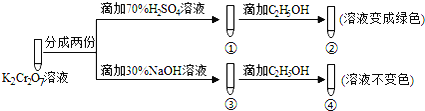
结合实验,下列说法不正确的是( )
A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72−被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
难度: 困难查看答案及解析
-
A、B、C、D四种物质之间的转化关系如图所示(部分产物已略去),下列说法正确的是( )
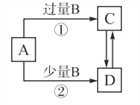
A. 若A为AlCl3溶液,B可能为氨水,反应①的离子方程式为:A13++4NH3·H2O=AlO2−+ 4NH4++2H2O
B. 若A为Fe,B可能为稀硝酸,反应②的离子方程式为: 3Fe+8H++2NO3−=3Fe2++2NO↑+4H2O
C. 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴别C、D溶液
D. 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3
难度: 中等查看答案及解析
-
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的质量分数为( )
A. 25% B. 75% C. 88% D. 32%
难度: 中等查看答案及解析
-
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
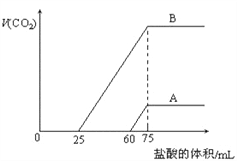
A. A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3和NaHCO3
B. B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3-
C. B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL
D. 原NaOH溶液的物质的量浓度为1.0mol/L
难度: 中等查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示。则下列分析正确的是( )

A. 图1中,a到b的过程中有0.01 mol电子发生了转移
B. 图1整个过程中共生成0.26 g水
C. 图2三条曲线中,表示CuO和其所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
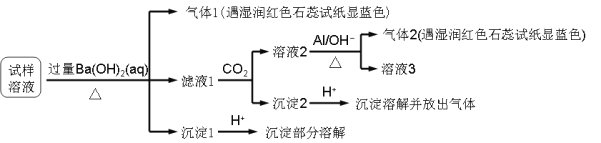
已知:3NO3-+8Al+ 5OH-+2H2O
3NH3+8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A. 试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B. 试样中一定不含Al3+
C. 试样中可能存在Na+、Cl-
D. 该雾霾中可能存在NaNO3、NH4Cl和MgSO4
难度: 中等查看答案及解析

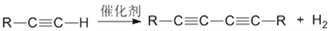
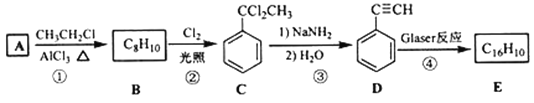
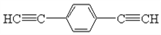 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________________________________________________________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________________________________________________________________________________。