-
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA
B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.在1 L 0.1 mol•L-1碳酸钠溶液中,阴离子总数大于0.1 NA
D.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA难度: 中等查看答案及解析
-
在下列各溶液中,离子可能大量共存的是( )
A.无色溶液中:Al3+、Na+、SO42-、AlO2-
B.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-
C.含有大量ClO-的溶液中:K+、H+、I-、SO32-
D.水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3-难度: 中等查看答案及解析
-
下列离子方程式中,不正确的是( )
A.浓烧碱溶液中加入铝片:Al+OH-+H2O=AlO2-+H2↑
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O
C.食醋和小苏打溶液混合:CH3COOH+HCO3-=CH3COO-+H2O+CO2↑
D.敞开体系,向FeCl2溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式,下列判断正确的是( )
①I2(g)+H2(g)⇌2HI(g)+9.48kJ
②I2(S)+H2(g)⇌2HI(g)-26.48kJ.
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96kJ热量时转移2mole-
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘比1 mol气态碘所含能量多了17.00 kJ难度: 中等查看答案及解析
-
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应,以上反应类型能体现这一原子最经济原则的是( )
A.①②⑤
B.②⑤⑦
C.只有⑦
D.只有②难度: 中等查看答案及解析
-
下列化学用语或模型表示正确的是( )
A.H2O2分子结构式:H一O一O一H
B.氮气的电子式:N⋮⋮N
C.Mg2+结构示意图:
D.C2 H4分子比例模型: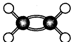
难度: 中等查看答案及解析
-
将一定量的SO2通入Ba(NO3)2溶液中,下列离子反应一定不会发生的是( )
A.Ba2++SO2+H2O═BaSO3↓+2H+
B.Ba2++SO42-═BaS04↓
C.3SO2+2H2O+2NO3-═3SO42-+4 H++2NO↑
D.4SO2+5H2 O+NO3-═4SO42-+NH4++6 H+难度: 中等查看答案及解析
-
下列实验合理的是( )

A.①实验只能得到红褐色沉淀
B.②实验吸收氨气,并防止倒吸
C.③实验制备并收集少量NO2气体
D.④实验制备并收集少量O2气体难度: 中等查看答案及解析
-
用来表示可逆反应:2A(g)+B(g)≒2C(g) (△H>0)的正确图象( )
A.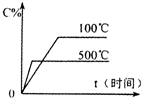
B.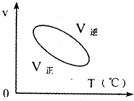
C.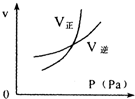
D.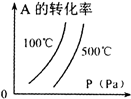
难度: 中等查看答案及解析
-
已知电池总反应为:Zn+2MnO2+H2O
ZnO+2MnO(OH).下列说法正确的是( )
A.放电时,Zn为负极,ZnO为正极,MnO2为催化剂
B.放电时,该电池的正极反应为:MnO2+e-+H2O═MnO(OH)+OH-
C.充电时,电池将化学能转为电能
D.放电时,溶液中的阴离子向原电池的正极移动难度: 中等查看答案及解析
-
我国在砷化镓太阳能电池研究方面国际领先.砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA和ⅢA族.下列说法中,不正确的是( )
A.原子半径:Ga>As>P
B.热稳定性:NH3>PH3>AsH3
C.酸性:H3AsO4>H2SO4>H3PO4
D.Ga(OH)3 可能是两性氢氧化物难度: 中等查看答案及解析
-
下列说法正确的是( )
A.向某溶液中滴加KSCN 溶液,溶液呈红色,证明存在Fe3+而没有Fe2+
B.铝箔在酒精灯火焰上加热熔化但不滴落,因为铝箔表面氧化铝熔点高于铝
C.向煤中加入适量石灰石,在煤燃烧时最终生成CaSO3,可减少SO2对大气的污染
D.为确证NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3难度: 中等查看答案及解析
-
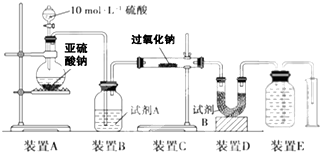
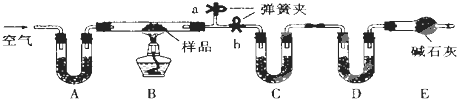
化学是建立在实验基础上的学科.关于下列各实验装置的叙述中,不正确的是( )
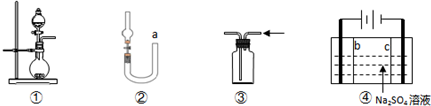
A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
A.1mol由元素A、B组成的化合物一定含有18mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与CE含有相同类型的化学键难度: 中等查看答案及解析
-
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2═3CO2+N2O.下列关于N2O的说法一定正确的是( )
A.上述反应,每生成lmol N20,消耗67.2L CO
B.等物质的量的N2O和CO2含有相等的电子数
C.N2O只有氧化性,无还原性
D.N2O会迅速与人体血红蛋白结合,使人中毒难度: 中等查看答案及解析
-
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)⇌bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息,下列说法正确的是( )
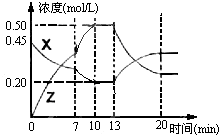
A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L•min
B.根据上图可求得方程式中a:b=1:3
C.推测在第7min时曲线变化的原因可能是升温
D.推测在第13min时曲线变化的原因可能是降温难度: 中等查看答案及解析
-
某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:

现对A、B、C、D作出的如下推断中,不正确的是( )
A.盐A一定是FeBr3
B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+
D.D溶液中有Fe(SCN)3难度: 中等查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
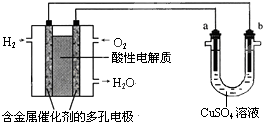
A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等难度: 中等查看答案及解析
-
化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,△H的值为( )
化学键 Si-O O═O Si-Si Si-Cl Si-C 键能kJ•mol-1 460 498.8 176 360 347 
A.-989.2 kJ•mol-1
B.+989.2 kJ•mol-1
C.-61.2 kJ•mol-1
D.-245.2 kJ•mol-1难度: 中等查看答案及解析
-
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.下列判断正确的是( )
A.一定不含Fe3+和Fe2+
B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C.溶液可能含有NO3-
D.一定含有Fe3+,但一定不含Fe2+难度: 中等查看答案及解析
-
将11.9g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7g.另取等质量的合金溶于过量稀硝酸中,生成了6.72L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1g
B.27.2g
C.30g
D.无法计算难度: 中等查看答案及解析