-
下列现象与电化学腐蚀无关的是
A. 炒菜的铁锅未及时洗干净(残液中含NaCl)而生锈
B. 海军黄铜(含Zn、Cu和1%的Sn)不易产生铜绿
C. 银质物品久置表面变暗
D. 钢铁在潮湿的露天环境中容易生锈
难度: 中等查看答案及解析
-
下列说法正确的是
A. 煤、石油和天然气都是清洁能源
B. 所有的燃烧反应都是放热反应
C. 生活和生产中最常用的燃料里所含的主要元素为氧元素
D. 从能量角度看,断开化学键会释放能量,形成化学键会吸收能量
难度: 简单查看答案及解析
-
原电池中发生的反应属于
A. 氧化还原反应 B. 化合反应 C. 分解反应 D. 复分解反应
难度: 简单查看答案及解析
-
核素
(镤)的原子核内中子数与核外电子数之差为
A. 55 B. 91 C. 146 D. 237
难度: 简单查看答案及解析
-
下列物质中,既含有极性键又含有离子键的是
A. Na2O2 B. NH4Cl C. CaH2 D. NaCl
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 稀有气体元素的原子最外层电子数均为8 B. 在化合物中,非金属元素均显负价
C.
可表示CH4或CCl4分子 D. 16O、17O、18O互为同位素
难度: 简单查看答案及解析
-
下列关于电极的说法正确的是
A. 铜电极只能作正极 B. 电解精炼铜时,纯铜与电源正极相连
C. 原电池的负极得到电子 D. 电解池的阳极失去电子
难度: 中等查看答案及解析
-
纽约一家公司设计出Soccket足球,每被踢一下,就会把能量储存起来;被储存的能量可以通过USB 接口给手机等充电。在Soccket足球充放电的过程中,下列有关能量转化的说法中正确的是

A. 踢球时,化学能转化为电能 B. 踢球时,电能转化为机械能
C. 手机充电时,电能转化为化学能 D. 手机充电时,化学能转化为电能
难度: 简单查看答案及解析
-
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。a、d相连, a为正极;a、c相连,c为正极;b、c相连,b为正极。则这四种金属的金属性最强的是
A. a B. b C. c D. d
难度: 简单查看答案及解析
-
对于反应X(g)+Y(s)=2Z(g) ,下列条件不能改变化学反应速率的是
A. 升高温度 B. 加入催化剂 C. 再加入一定量的Y D. 扩大容器体积
难度: 简单查看答案及解析
-
符合下列条件的反应一定能自发进行的是
A. △S>0 △H<0 B. △S<0 △H<0 C. △S>0 △H>0 D. △S<0 △H>0
难度: 简单查看答案及解析
-
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2 ,下列说法不正确的是

A. 太阳能最终转变为化学能 B. T<1050℃时,CeO2-δ比CeO2稳定
C. CeO2是水分解的催化剂 D. 两步反应均属于氧化还原反应
难度: 中等查看答案及解析
-
向二氯化铂的HCl溶液中通入乙烯气体,再加入KCl可得K[Pt(C2H4)Cl3]·H2O(蔡氏盐),下列有关化学用语表示正确的是
A. KCl的电子式:
B. 乙烯的结构简式:CH2CH2
C. 中子数为117,质子数为78的铂原子:
D. K+的结构示意图:
难度: 中等查看答案及解析
-
已知SO3在催化剂作用下分解速率会加快,其能量随反应进程的变化如图所示。下列说法正确的是
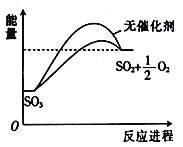
A. 加入催化剂,减小了反应的活化能 B. 加入催化剂,可提高SO3的平衡转化率
C. 降低温度,SO3的分解速率加快 D. 反应物的总能量大于生成物的总能量
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z在周期表中的位置如图所示。下列说法正确的是
W
X
Y
Z
A. 原子半径:W>X>Y
B. W、X、Y不能存在于同一离子化合物中
C. 最简单气态氢化物的稳定性:W<Z
D. X、Y、Z的最高价氧化物对应的水化物两两之间均能发生反应
难度: 中等查看答案及解析
-
一定条件下NH3(g)和NO(g)发生反应:2NH3(g)+8NO(g)
5N2O(g)+3H2O(g)。设起始时
,恒压下,平衡时NH3的体积分数φ(NH3)与Z和T(温度)的关系如图所示,下列说法正确的是
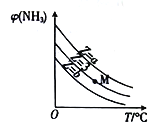
A. 升高温度,该反应的平衡常数(K)减小
B. b<3<a
C. M点对应的平衡混合物中
D. 温度不变时,M点对应的平衡在加压后φ(NH3)增大
难度: 中等查看答案及解析
-
美国大推力运载火箭“太空发射系统”将于2018年执行首次飞行任务,其所需燃料为高能火箭燃料肼(H2N—NH2)。该物质燃烧过程中的能量变化如图所示。
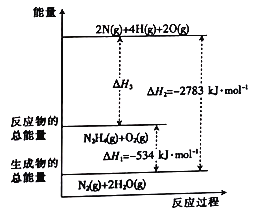
已知:
化学键
N—N
O=O
N≡N
O—H
N—H
断开1mol共价键所需的能量/kJ
159
498
943
460
a
下列判断错误的是
A. 表中的a=389
B. 图示中的△H3=-2249kJ/mol
C. N2比O2稳定
D. N2H4在氧气中燃烧的热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
难度: 中等查看答案及解析
-
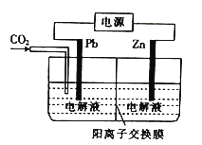
“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。下列有关说法中错误的是

A. 该装置将化学能转变为电能
B. 利用该技术可捕捉大气中的CO2
C. 该装置工作时,理论上每生成1mol草酸铝,电路中通过6mol电子
D. 该装置工作时,正极上的电极反应式为2CO2-2e-=C2O42-
难度: 中等查看答案及解析
-
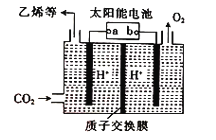
某新型燃料电池能以乙烯为原料制备乙醛并获得电能,工作原理如图所示。下列有关说法正确的是
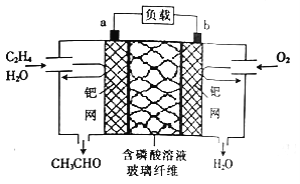
A. a 电极为正极
B. 电子移动方向:a 电极→磷酸溶液→b电极
C. a 极的电极反应式为CH2=CH2+2OH--2e-=CH3CHO+H2O
D. 放电时,若有2mol电子转移,则理论上需要消耗28g乙烯
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。m、n、p是由这些元素组成的二元化合物,W2、X2、Z2分别是元素W、X、Z的单质。已知I.一定条件下某密闭容器中可发生反应aX2+bW2
cm,反应过程中物质的浓度变化如下:
X2
W2
m
起始浓度/mol/L
0.4
0.4
0
平衡浓度/mol/L
0.3
0.1
0.2
Ⅱ.它们可发生如下反应:2m(g)+3Z2(g)=6n(g)+X2(g);4n(g)+Y2(g)
2p(l)+2Z2(g)。下列说法正确的是
A. m、n、p三种物质均为共价化合物
B. a:b:c=3:1:2
C. X的氧化物一定是无色气体
D. 原子半径:W<X<Y
难度: 中等查看答案及解析
-
已知:乙二醛可被催化氧化为乙醛酸,其反应为2OHC-CHO(g)+O2(g)
2OHC-COOH(g) △H。一定条件下,按照
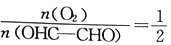 的投料比进行上述反应,乙二醛的平衡转化率(α)和催化剂的催化效率随温度的变化如图所示。下列叙述正确的是
的投料比进行上述反应,乙二醛的平衡转化率(α)和催化剂的催化效率随温度的变化如图所示。下列叙述正确的是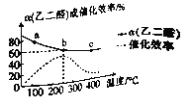
A. △H>0
B. b点时,乙二醛的体积分数为33.33%
C. 生成乙醛酸的速率:v(a)>v(b)>v(c)
D. a、b、c三点中,a点乙醛酸的体积分数最小
难度: 中等查看答案及解析
-
常温下,A是只含X和Y两种短周期元素的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素的单质,Z是地壳中含量最高的元素。甲、乙、丙和B、C、D都是常见的物质,其转化关系如图所示。下列说法正确的是
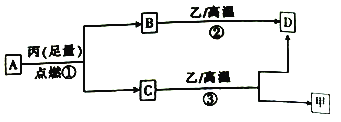
A. 原子半径:Z>Y>X
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的氢化物为气态
D. 由X、Y、Z三种元素组成的化合物可能是离子化合物
难度: 中等查看答案及解析
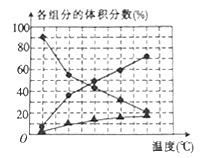
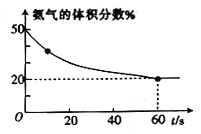
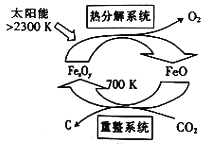
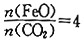 ,则重整系统中发生反应的化学方程式为______________。
,则重整系统中发生反应的化学方程式为______________。