-
水是最宝贵的资源之一。下列表述正确的是
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A.标准状况下,1 L庚烷所含有的分子数为NA/22.4
B.1 mol甲基(—CH3)所含电子数为9NA
C.标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA
D.26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
难度: 简单查看答案及解析
-
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同,下列事实不能说明上述观点的是
A.苯酚能与NaOH溶液反应,乙醇不能与NaOH溶液反应
B.甲苯能使酸性高锰酸钾溶液褪色,乙烷不能使酸性高锰酸钾溶液褪色
C.乙烯能发生加成反应,乙烷不能发生加成反应
D.苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
难度: 简单查看答案及解析
-
下列各操作中,正确的是
A. 为减缓反应速率,用饱和食盐水与电石反应制乙炔
B. 进行酸碱中和滴定时,锥形瓶应用待测液润洗
C. 实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸
D. 配制FeCl3溶液时,加入少量稀硫酸抑制其水解
难度: 简单查看答案及解析
-
常温下下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+
C.c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42—、SCN-
难度: 简单查看答案及解析
-
对于0.1mol·L-1 Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+ c(HSO3-)+ c(H2SO3)
C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
难度: 中等查看答案及解析
-
绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的“原子经济性”反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A.乙烯与氧气在银催化作用下生成环氧乙烷(
)
B.乙烷与氯气制备氯乙烷
C.苯和乙醇为原料,在一定条件下生产乙苯
D.乙醇与浓硫酸共热制备乙烯
难度: 中等查看答案及解析
-
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
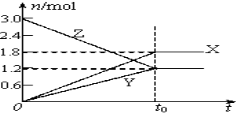
A.该反应的化学方程式为:3X+2Y
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
难度: 简单查看答案及解析
-
将大小相同、质量相等的镁条放入下列溶液中,反应速率按由大到小顺序排列正确的是
已知:醋酸的Ka=1.8×10-5, 亚硫酸Ka1=1.54×10-2,①2 mol/L H2SO3, ②2 mol/L HAc,③2 mol/L的HAc中加入少量的NaAc固体 ④2 mol/L的盐酸
A.①③②④ B.④①②③ C.④①③② D.①④③②
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是:
A.充电时阳极反应:Ni(OH)2 — e-+ OH-=NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH—向正极移动
难度: 简单查看答案及解析
-
某可逆反应为2X(g)
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
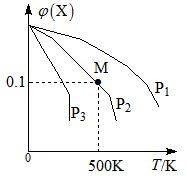
下列推断正确的是
A.升高温度,该反应平衡常数K减小
B.压强大小为:P3>P2>P1
C.平衡后加入高效催化剂使Mr增大
D.在该条件下M点X平衡转化率为
难度: 简单查看答案及解析
-
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
难度: 简单查看答案及解析
-
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系 如图所示,下列说法中不正确的是( )
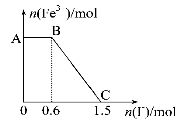
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7与FeSO4开始反应时物质的量之比为1∶3
难度: 简单查看答案及解析
-
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
A.1mol该有机物最多可以和4mol Na反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
难度: 简单查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为
A.0.15 mol·L-1
B.0.2 mol·L-1
C.0.3 mol·L-1
D.0.4 mol·L-1
难度: 中等查看答案及解析
-
25℃时,KSP Mg(OH)2 = 5.61 ×10-12 ,KSP MgF2 = 7.42 ×10-11下列说法正确的是
A.25℃时,固体Mg(OH)2在20ml0.01 mol·L-1氨水中的KSP比20mL0.01 mol·L-1NH4Cl溶液中的KSP小
B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
C.25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
D.25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
难度: 困难查看答案及解析
-
由乙醇制取
时最简便的流程需经下列哪些反应
①取代 ②加成 ③氧化 ④还原 ⑤消去 ⑥酯化
A.①②③④⑥ B.⑤②①③⑥ C.⑥③①②⑤ D.①②⑤③⑥
难度: 中等查看答案及解析