-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+1/2 O2(g)=CO(g) △H= ―393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D. C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 电能是二次能源 B. 水力是二次能源
C. 天然气是二次能源 D. 水煤气是一次能源
难度: 简单查看答案及解析
-
下列各组热化学方程式中,ΔH1>ΔH2 的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g)ΔH1 S(g)+O2(g)===SO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH1 H2(g)+O2(g)===2H2O(l) ΔH2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A. 碳酸钙受热分解 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 物质发生化学变化都伴随着能量变化
B. 任何反应中的能量变化都表现为热量变化
C. 伴有能量变化的物质变化都是化学变化
D. 放热反应都不需要加热就能发生
难度: 中等查看答案及解析
-
已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1,则HCl(g)=
H2(g)+
Cl2(g)的△H为()
A. +184.6kJ·mol-1 B. ―92.3kJ·mol-1 C. ―369.2kJ·mol-1 D. +92.3kJ·mol-1
难度: 中等查看答案及解析
-
1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是 ( )
A. C(固)+O2(气)=CO2(气); △H =+393.5 kJ/mol
B. C(固)+
O2(气)=CO(气); △H =-393.5 kJ/mol
C. C + O2 = CO2 ;△H =-393.5 kJ/mol
D. C(固)+O2(气)=CO2(气); △H =-393.5 kJ/mol
难度: 中等查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+
O2(g) == H2O(1) △H= ―285.8kJ/mol
难度: 中等查看答案及解析
-
已知热化学方程式:SO2(g)+1/2O2(g)
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
A. 196.64kJ B. <196.64kJ/mol C. <196.64kJ D. >196.64kJ
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ― Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
则0.4mol甲烷和0.1mol氢气的混合气体经完全燃烧后恢复至常温,则放出的热量为( )KJ。
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
难度: 中等查看答案及解析
-
已知下列两个热化学方程式:2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol,实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比为( )
A. 1:3 B. 1:4 C. 3:1 D. 1:1
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g)=H2(g) +
O2(g) △H = +241.8kJ/mol
H2(g)+
O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是( )。
A. 吸热88kJ B. 吸热2.44KJ C. 放热44kJ D. 吸热44KJ
难度: 中等查看答案及解析
-
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
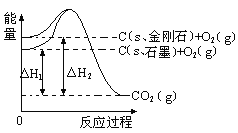
A. C(s、石墨)== C(s、金刚石) △H= +1.9 kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 金刚石的能量比石墨的低
难度: 中等查看答案及解析
-
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是( )
A. 0.2Q B. 0.1Q C. 5Q D. 10Q
难度: 简单查看答案及解析
