-
化学与生产、生活、科技、环境等密切相关,下列说法不正确的是
A.雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理
B.聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,
C.用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气
D.用合成聚碳酸酯可降解塑料,实现“碳”的循环利用
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下,1L0.1mol/LNH4NO3溶液中的氮原子数为0.2NA
B.常温下,向含1molH2SO4的浓硫酸加入足量的铁粉,转移的电子数为2NA
C.标准状况下,2.24L己烷分子中含有1.9NA对共用电子
D.将1mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA
难度: 中等查看答案及解析
-
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
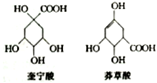
A.二者均能与小苏打溶液反应产生气泡,均能发生酯化反应
B.可用高锰酸钾溶液鉴别奎宁酸和莽草酸
C.在铜催化作用下二者均能被O2氧化
D.二者可用溴水来鉴别,不能用NaOH溶液鉴别
难度: 中等查看答案及解析
-
原子结构决定元素的性质,下列说法中正确的是
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小,
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高
C.第二周期元素的最高正化合价都等于其原子的最外层电子数
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
难度: 中等查看答案及解析
-
有机物Q的分子式为C5H10O3,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为1:1,则Q的结构最多有( )
A.12种 B.10种 C.8种 D.7种
难度: 困难查看答案及解析
-
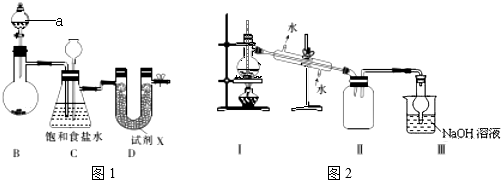
利用下列实验装置能完成相应实验的是


A.制取并收集HCl B.实验室制氨气
C.除去氯气中的氯化氢 D.分离液体混合物
难度: 中等查看答案及解析
-
室温下进行相关实验。下列结论正确的是
A.向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+c(CO32-)
B.向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-)
C.向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13
D.将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-)
难度: 中等查看答案及解析
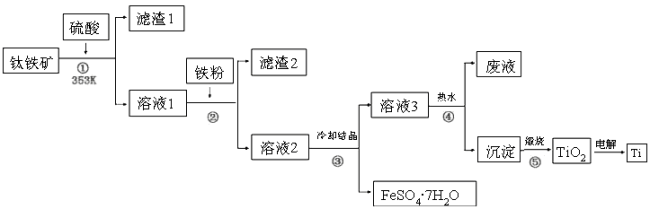
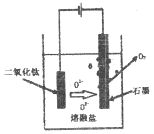



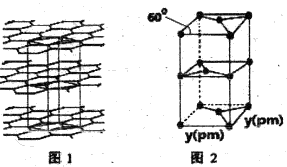
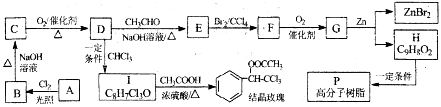
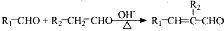 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)