-
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为﹣33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。
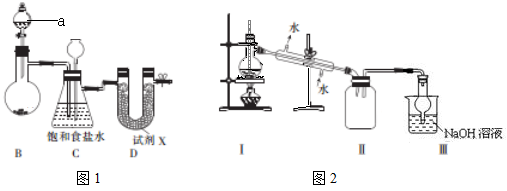
I.图1是实验室制备干燥氯气的实验装置(夹持装置已略)
a的仪器名称 该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,B中发生反应的化学方程式为
(2)装置C中饱和食盐水的作用 同时装置C亦是安全瓶,能检测实验进行时D中是否发生堵塞,请写出发生堵塞时C中的现象
(3)试剂X可能为 (填写字母)
A无水氯化钙 B浓硫酸 C 碱石灰 D五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式
(5)用锡花代替锡粒的目的是
II.图2是蒸馏SnCl4的装置
(6)①蒸馏前若发现烧瓶中液体呈黄色,可采取的措施是
②该装置尚有两处不当之处,它们分别是 ,
③写出III中发生反应的离子方程式
-
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2.实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。
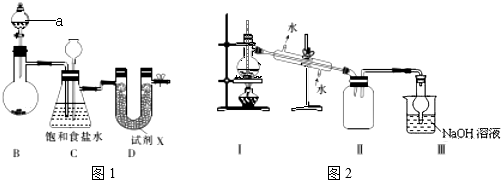
Ⅰ.图1示实验室制备干燥氯气的实验装置(夹持装置己略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,A中发生反应的化学方程式为_____________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有_____________作用。
(3)试剂X可能为_____________(填写字母).
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式_____________。
(5)用锡花代替锡粒的目的是_____________。
II.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是_____________、_____________。
(7)实验用的锡花中含有金属铜。甲同学设计下列实验测定锡花的纯度。
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用1.000mol/LK2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为(未配平):
Fe2++Cr2O72-+H+→Cr3++Fe3++H2O
若达到滴定终点时共消耗20.00mlK2Cr2O7溶液,试计算锡花中锡的百分含量_____________(结果保留三位有效数字)。
-
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
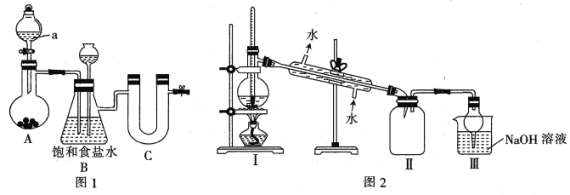
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为_________________________________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用。
(3)试剂Ⅹ可能为___________(填标号)。
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________。
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________。
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________。
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为Fe2++Cr2O72-+H+→Cr3++Fe3++H2O(未配平)
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)。
-
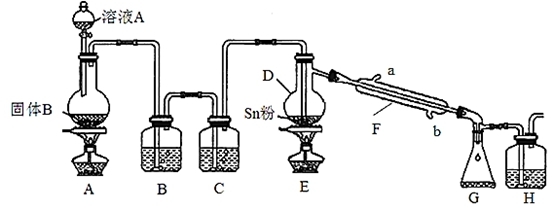
四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡。已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室可用下列装置合成四氯化锡(夹持装置略)。
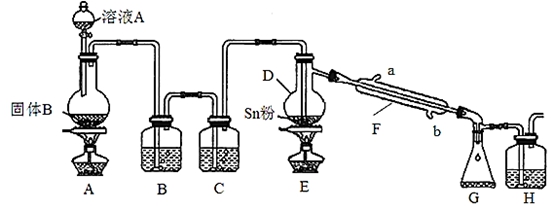
(1)装置D的名称为 ;
(2)冷凝水应从 (填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为 ;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为 ;
(5)装置E中加热的目的是 、 ;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为 。
(7)该实验装置存在设计缺陷,你的改进措施为 。
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20 g SnCl4,则SnCl4的产率为 (已知SnCl4相对分子质量为261)。
-
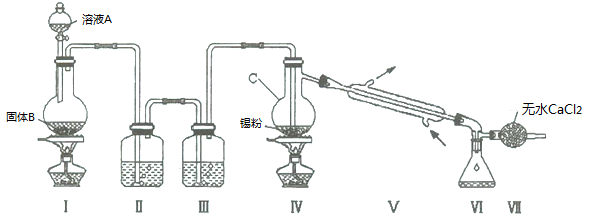
四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡。已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室可用下列装置合成四氯化锡(夹持装置略)。
(1)装置D的名称为 ;
(2)冷凝水应从 (填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为 ;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为 ;
(5)装置E中加热的目的是 、 ;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为 。
(7)该实验装置存在设计缺陷,你的改进措施为 。
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20 g SnCl4,则SnCl4的产率为 (已知SnCl4相对分子质量为261) 。
-
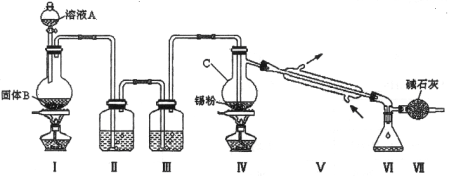
氯气与金属锡在加热时反应可以用来制备SnCl4 。已知:四氯化锡是无色液体,熔点-33 ℃,沸点114 ℃。SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)该装置存在的缺陷是: ;
(5)如果没有装置Ⅲ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到24.8 g SnCl4 ,则SnCl4 的产率为 。
-
四氯化锡是无色液体,熔点-33℃,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4 极易水解,在潮湿的空气中发烟。实验 室可以通过下图装置制备少量SnCl4 (夹持装置略)。
室可以通过下图装置制备少量SnCl4 (夹持装置略)。
(1)仪器C的名称为: ;
(2)装置 Ⅰ中发生反应的离子方程式为:
Ⅰ中发生反应的离子方程式为:  ;
;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
-
锡为第IVA族具有可变价的金属元素,其单质沸点为2260℃。四氯化锡(SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4 (夹持装置已略去)。
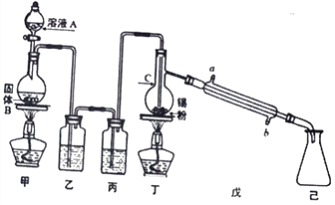
(1)仪器C的名称为___________,装置乙中的试剂是_____________。
(2)装置甲中发生反应的化学方程式为___________________________________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_____________。
(4)你认为该实验装置需要进行的改进是:__________________________________________。
(5)用下列方法和步骤测定所用金属锡样品的纯度(杂质不参加反应)
①将2.000g锡完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液,最后得100.00mL 溶液。写出第二步反应的离子方程式:_____________________________。
②取①所得溶液amL用0.100 mol·L-1 的K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+ 14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
K2Cr2O7溶液应注入到____式(填"酸或碱”) 滴定管中。到达滴定终点时用去bmL。则样品中锡的质量分数为_______%(用含a、b 的最简代数式表示)。
-
SnCl4是一种重要的工业原料,常作媒染剂等。已知SnCl4常温下是无色液体,在潮湿空气中易水解,熔点-36℃,沸点114℃。工业上制备SnCl4的工艺流程如下:

请回答下列问题:
(1)粗锡电解精炼时,常用硅氟酸(化学式为H2SiF6)和硅氟酸亚锡(化学式为SnSiF6)为电解液。已知H2SiF6为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为______。硅氟酸有腐蚀性,能与SiO2反应。电解时可选取下列电解槽中的________。
a.玻璃电解槽 b.不锈钢电解槽 c.塑料电解槽
阴极发生的电极反应式为_________。
(2)某同学模拟工业制法设计了由Sn与Cl2反应制取SnCl4的实验装置如下:
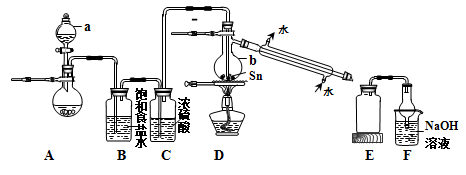
①a中浓盐酸与烧瓶内固体反应生成Cl2,则烧瓶内固体可以选用_________;仪器b的名称为_________。
②装置D的主要缺点是___________;除此之外,整套装置还有的缺点是_______。
③SnCl4溶液中加入适量的NaOH溶液,产生白色沉淀(二元酸),再加过量的NaOH溶液,白色沉淀溶解。试写出反应生成白色沉淀的离子方程式_________。
④若实验中取用锡粉5.95 g,反应后,E中广口瓶里收集到12.0 g SnCl4。则SnCl4的产率为_________。
-
熔触的金属锡在300℃左右能直接与氯气作用生成四氯化锡。四氯化锡的熔点-33℃,沸点114℃,遇潮湿空气水解。某学习小组用以下装置制取少量四氯化锡。回答下列问题:
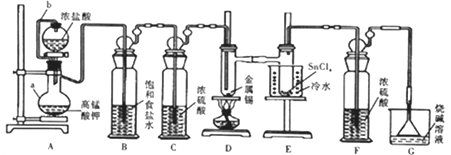
(1)仪器组装完毕,为检查装置的气密性,将装置G中漏斗改为导管且管口浸没于水中,后续操作
是__________,说明气密性良好。
(2)仪器a的名称是__________;设计连接管b的目的是_______________。
(3)装置B、F的作用分別是______________、____________。
(4)装置A中反应的离子方程式为______________,排尽装置中的空气后才能点燃D处的酒精灯,判断装置中的空气已排尽的现象是_____________;D中加热的作用之一是加快氯气与金属锡反应,另一作用是__________。
(5)四氯化锡遇潮湿空气时有白色烟雾产生,同时生成白色固体(SnO2·xH2O),该反应的化学方程式为_____________。
(6)实验结束后,若制得SnCl4的质量为2.61g,Cl2的转化率为80%,则消耗KmnO4的质量为__________。










