-
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g)ΔH<0,则下列叙述不正确的是
A.该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以反应前后物质具有的总能量不变
B.上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C.该反应的化学能可以转化为其他形式的能
D.反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是

A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH
C.改变催化剂,不能改变该反应的活化能
D.有催化剂条件下,反应的活化能等于E1+E2[]
难度: 中等查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) =2H2O(1) △H= ―285.8kJ/mol
B.2H2(g)+ O2(g) =2H2O(1) △H= +571.6 kJ/mol
C.2H2(g)+O2(g) =2H2O(g) △H= ―571.6 kJ/mol
D.H2(g)+
O2(g) =H2O(1) △H= ―285.8kJ/mol
难度: 中等查看答案及解析
-
在进行中和热的测定中,下列操作正确的是
A.使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5 mol·L﹣1 NaOH溶液分别与0.5mol·
L﹣1的盐酸、醋酸溶液
反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
难度: 中等查看答案及解析
-
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+1/2O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
难度: 中等查看答案及解析
-
已知2H2(g)+O2(g) =2H2O(l) ΔH=-569.6kJ/
mol,
2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol.
现有1 g液态H2O,蒸发时吸收的热量是
A.2.43 kJ B.4.86 kJ C.43.8 kJ D.87.5 kJ
难度: 中等查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3 ΔH=-92.4 KJ/mol,则N≡N键的键能是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
难度: 中等查看答案及解析
-
室温下将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)= CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A、△H2>△H3 B、△H1>△H3
C、△H1 =△H2+△H3 D、△H1+△H2 >△H3
难度: 中等查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol/(L·s) B.v(B)= 0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率增大的是
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,充入N2 D.保持压强不变,充入N2
难度: 中等查看答案及解析
-
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.升高温度 B.加入一种反应物
C.对平衡体系增加压强 D.使用催化剂
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),60s达到平衡,生成0.3 mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.平衡向逆反应方向移动了
C.物质A的质量分数增加了 D.b<a
难度: 中等查看答案及解析
-
升高温度时,化学反应速率加快,主要原因是
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.活化能降低,活化分子百分数增加
难度: 简单查看答案及解析
-
对已达平衡状态的反应:2X(g)+Y(g)
2Z(g),增大压强时下列说法正确的是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)
2HI(g)达到平衡的标志是
A.H2、I2、HI的浓度相等 B.H2、I2、HI的浓度保持不变
C.混合气体的密度保持不变 D.H2、I2、HI的浓度比为1:1:2
难度: 中等查看答案及解析
-
一定条件下反应 2AB(g)
A2(g)+B2(g)达到平衡状态的标志是
A.容器中混合气体的质量不随时间变化
B.容器内三种气体 AB、A2、B2共存
C.v正(AB)=2v逆(A2)
D.单位时间内消耗n mol A2,同时生成2n mol AB
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
难度: 中等查看答案及解析
-
对于密闭容器中进行的反应CO(g)+H2O(g)
CO2 (g) +H2 (g),达到平衡后,其他条件不变,增大CO的浓度,下列说法不正确的是
A.正反应速率增大
B.逆反应速率先减小
C.达到平衡时,逆反应速率比原平衡要大
D.化学平衡常数不变
难度: 中等查看答案及解析
-
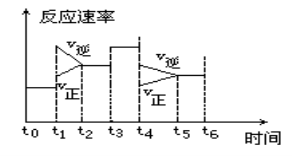
已知合成氨的反应为:N2 + 3H2
2NH3 ΔH= - 92.4 KJ/mol在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是
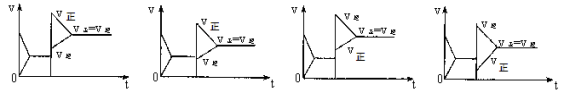
A B C D
难度: 中等查看答案及解析
-
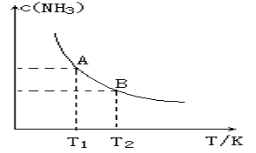
已知反应
,A的转化率
与p、T的关系如图,根据图示可以得出的正确结论是
A.正反应吸热,
B.正反应吸热,
C.
D.正反应放热,
难度: 中等查看答案及解析
-
一定自发进行的反应是
A.吸热反应 B.放热反应 C.熵增加反应 D.熵增加和放热反应
难度: 简单查看答案及解析
-
对于可逆反应:C(s)+H2O(g)
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的
是
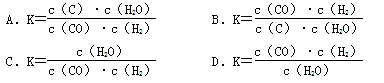
难度: 简单查看答案及解析
-
下列各式中,属于正确的电离方程式的是
A.HCO3-=CO32-+H+ B.NaHSO4 = Na+ +HSO4-
C.H3PO4
3H++PO43- D.NH3·H2O
NH4++OH-
难度: 简单查看答案及解析
-
把0.05molNaOH固体分别加入到100mL下列液体中,溶液的导电性变化不大的是
A.自来水 B.0.5mol/L氢氟酸溶液
C.0.5mol/L盐酸 D.0.5mol/L 醋酸
难度: 中等查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.c(F-)/c(H+) D .c(F-)/c(HF)
难度: 中等查看答案及解析
-
工业合成氨的反应为N2(g)+3H2(g)
2NH3(g)。设在容积为1.0 L的密闭容器中充入0.5 mol N2(g)和1.0mol H2(g),某温度下反应达到平衡时容器内压强为原来的2/3,则该反应的平衡常数
A .4 B.16 C.32 D.64
难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是
t℃
700
800
830
1 000
1 200
K
1.67
1.11
1.00
0.60
0.38
A.该反应的化学方程式是CO(g)+H2O(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.某温度下,如果平衡浓度符合下列关系式:
,判断此时的温度是1 000℃
难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ•mol-1、-1411.0kJ•mol-1和-1366.8kJ•mol-1,( C2H4 、C2H5OH(1)充分燃烧后的产物为CO2和H2O),则由C2H4(g)和H2O(l)反应生成C2H5OH(1)的△H为
A.-44.2kJ•mol-1 B.+44.2kJ•mol-1 C.-330kJ•mol-1 D.+330kJ•mol-1
难度: 中等查看答案及解析
-
右图中的曲线是表示其他条件一定时,2NO(g)+O2(g)
2NO2(g) ΔH<0反应中NO2的百分含量与温度的关系曲线,图中标有a 、b 、c 、d四点,其中表示未达到平衡状态,且v正>v逆的点是
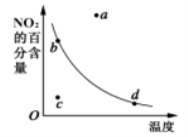
A.a点 B.b点 C.c点 D.d点
难度: 中等查看答案及解析