-
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
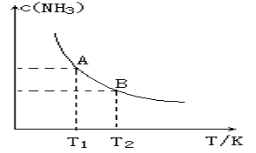
(1)当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为 。N2的转化率
(3)T1温度下该反应的化学平衡常数K1= 。
(4)500℃时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L, c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态______(填是或否),此时反应速率是v正________v逆(填 >, <, =).
(5)根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
已知:①2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③CO的燃烧热△H =-c kJ·mol-1。
写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
-
Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新 研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H =-b kJ·mol-1;CO的燃烧热△H =-c kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
-
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
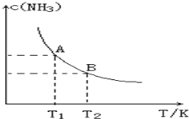
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0(填“>”或“<”)。
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_________,N2的转化率___________。
(3)T1温度下该反应的化学平衡常数K1=______________。
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。
-
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
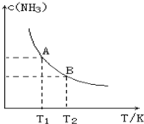
(1)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_____________。
(2)T1温度下该反应的化学平衡常数K1=______________。
(3)T1温度时,若测得容器中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态__________(填是或否),此时反应速率是v正_______v逆(填>或<或=)。
-
氮及其化合物是重要的化工原料

(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。当温度由T1变化到T2时,平衡常数关系K1 ______K2(填“>”、“<”或“=”),焓变△H______0(填“>”或“<”)。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 
 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是_____(填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是_____(填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(3)已知:2NO2(g) N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH________0(填写“>”、“<”或“=”)
② 一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡,达到平衡状态的标志 _______。
N2O4(g)达到平衡,达到平衡状态的标志 _______。
A.单位时间内生成n mol N2O4的同时生成2 nmolNO2
B.用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C.混合气体的颜色不再改变的状态
D.混合气体的密度不再改变的状态
E.混合气体的平均相对分子质量不再改变的状态
(4)17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2 mol·L-1,c(N2O4)=0.16 mol·L-1。则反应达到平衡时, NO2的转化率为__________;此温度下该反应的平衡常数K=________.
-
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定温度下发生反应。10分钟后达到平衡,此时容器内压强为反应开始时的0.8,则下列说法不正确的是( )
A.平衡常数K=0.44
B.该10分钟内v(H2)=0.1mol/L·min
C.N2的转化率为25%
D.若向该容器内充入He使压强增大,则化学平衡向正反应方向移动
-
在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定条件下发生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数为( )
A.0.34 B.0.64 C.0.44 D.0.54
-
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
A.若为定容容器,n(NH3)=1.2mol B.若为定压容器,n(NH3) >1.2mol
C.若为定容容器,n(NH3)>1.2mol D.若为定压容器,n(NH3)<1.2mol
-
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3。已知加入1molN2和4molH2时,达到平衡后生成amolNH3.有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
| 已知 编号 | 起始状态物质的量/mol | 平衡时NH3的 物质的量/mol |
| N2 | H2 | NH3 |
| 1 | 4 | 0 | a |
| ① | 1.5 | 9 | 0 | ________ |
| ② | ________ | ________ | 1 | 0.5a |
| ③ | m | g(g=4m) | 0 | ________ |
-
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
A、若为定容容器,n(NH3)=1.2mol B、若为定压容器,n(NH3) >1.2mol
C、若为定容容器,n(NH3)>1.2mol D、若为定压容器,n(NH3)<1.2mol



