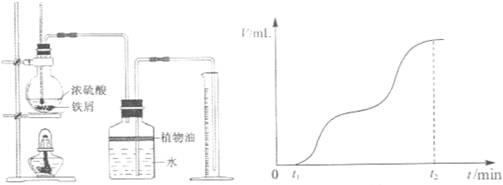
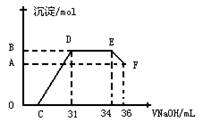
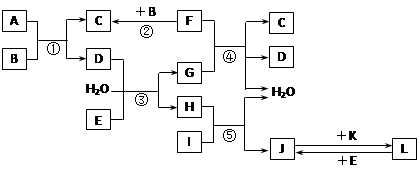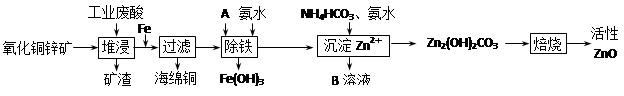-
现用胆矾(CuSO4•5H2O)配制0.1mol·L—1的硫酸铜溶液,下列操作中合理的是
A.称量时,将胆矾晶体直接放在托盘天平的右盘上
B.准确称取16.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,定容
C.准确称取25.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,定容
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
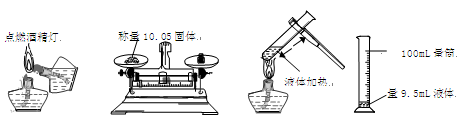
A B C D
难度: 简单查看答案及解析
-
下列实验操作正确的是
A.容量瓶用蒸馏水洗净后,没有干燥即用来配溶液
B.用湿润的pH试纸测量某溶液的pH值
C.容量瓶上只标有所配溶液的体积和刻度
D.在做蒸馏实验时应将温度计的水银球浸没在液体里
难度: 简单查看答案及解析
-
下列各组离子能大量共存的是
A.H+、Na+、HCO3-、Cl- B.Fe3+、SCN-、Cl-、NO3-
C.Mg2+、Fe2+、SO42-、NO3- D.Fe3+、SO42-、OH-、NO3-
难度: 简单查看答案及解析
-
下列反应不能通过一步反应制得的是
①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2
⑤Na2O→Na2SO4
A.①② B.③④ C.②③④ D.②③④⑤
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸反应制取二氧化碳:2H++CO32-==CO2↑+H2O
B.铁和稀硝酸反应:Fe+2H+==Fe2++H2↑
C.向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-==Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中的铵根离子:NH4++OH-
NH3↑+H2O
难度: 简单查看答案及解析
-
关于硝酸叙述正确的是
A.硝酸不稳定,见光或受热就会分解 B.稀硝酸是弱酸,浓硝酸是强酸
C.铜与稀硝酸反应生成二氧化氮 D.稀硝酸是弱氧化剂,浓硝酸是强氧化剂
难度: 简单查看答案及解析
-
检验下列离子时,仅用所选试剂或方法不能鉴别的是
A.Fe2+ (KSCN溶液) B.Cl- (稀硝酸酸化的AgNO3溶液)
C.NH4+ (NaOH溶液,加热) D.Na+ (焰色反应呈黄色)
难度: 简单查看答案及解析
-
铁在下列情况下腐蚀最快的是
A.铁放入海水中 B.将铁和锌连接后放入海水中
C.将铁和锌连接后放入淡水中 D.将铁和锡连接后放入海水中
难度: 简单查看答案及解析
-
氮的固定是指
A.植物从土壤中吸收含氮养料
B.将空气中的氮气转变为含氮化合物
C.豆科植物根瘤菌将含氮化合物转变为植物蛋白质
D.将氨转变成硝酸及其它氮的化合物
难度: 简单查看答案及解析
-
Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是
A.0.2mol/L B.0.1mol/L C.0.45mol/L D.0.225mol/L
难度: 简单查看答案及解析
-
CO、H2在一定条件下合成乙醇:2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g) △H=—255.6 kJ·mol—1,下列说法错误的是
A.反应物的总能量大于生成物的总能量
B.增大H2浓度可以使CO转化率达到100℅
C.使用合适的催化剂、升高温度均可加大反应速率
D.反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零
难度: 简单查看答案及解析
-
在水溶液中能大量共存的离子组是
A.Mg2+、NH4+、Cl—、OH— B.Na+、AlO2—、CO32—、OH—
C.Ca2+、Fe3+、H+、NO3— D.Fe3+、K+、SCN—、SO42—
难度: 简单查看答案及解析
-
制备单质硅的主要化学反应如下:
①SiO2+2C
i+2CO↑ ②Si+2Cl2 SiCl4
③SiCl4+2H2
Si+4HCl
下列对上述三个反应的叙述中,错误的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.三个反应的反应物中硅元素均被氧化
D.①是工业上制粗硅的反应,②③是粗硅提纯的反应
难度: 简单查看答案及解析
-
对下列有机反应类型的认识中,错误的是
A.
;取代反应
B.CH2=CH2 + Br2→CH2Br-CH2 Br;加成反应
C.2CH3CH2OH+O2
2CH3CHO+2H2O;取代反应
浓H2SO4
D.CH3COOH + CH3CH2OH
CH3COOCH2CH3+H2O;氧化反应
难度: 简单查看答案及解析
-
下列有关化学能与热能的说法正确的是
A.铝热反应属于吸热反应
B.H2→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.若某反应生成物的总能量大于反应物的总能量,则该反应为放热反应
难度: 简单查看答案及解析
-
下列说法中,错误的是
A.天然气的主要成分是CH4
B.淀粉、纤维素、蚕丝、油脂都是高分子化合物
C.煤是由有机物和无机物组成的复杂的混合物
D.石油的分馏产品如汽油、煤油、柴油等都是混合物
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,48 g O2和O3 含有的氧原子数均为3NA
B.常温常压下,11.2 L乙烯(C2H4)含有2NA个碳原子
C.1.7 g氨气所含有的电子数目为10 NA
D.2.7g铝与足量氢氧化钠溶液反应转移的电子数NA
难度: 简单查看答案及解析
-
下图是某同学做Zn-Cu原电池实验所做的读书卡片记录,其中描述合理的组合是

A.①②③ B.②③④ C.③④⑤ D.④⑤⑥
难度: 简单查看答案及解析
-
标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是 ( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为8∶7
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
难度: 简单查看答案及解析