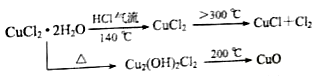
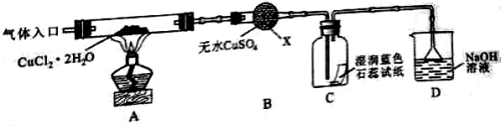
-
化学在生活中有着广泛的应用,下列对应关系错误的是 ( )
化学性质
实际应用
A.
Al2(SO2)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
Fe3+腐
蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
难度: 中等查看答案及解析
-
下列中草药煎制步骤中,属于过滤操作的是 ( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存

难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间
B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L
C.0.2 mol·L-1 Na2S溶液中含有的S2-数目小于0.2NA
D.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA
难度: 简单查看答案及解析
-
根据侯氏制碱原理制
备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
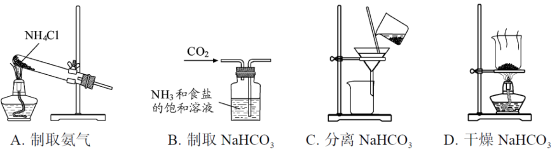
难度: 简单查看答案及解析
-
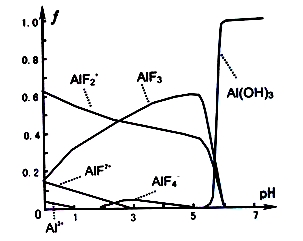
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
难度: 简单查看答案及解析
-
由Al2O3、MgO、SiO2、Fe2O3组成的混合粉末.现取一份该混合粉末试样进行实验,首先将其溶于过量的盐酸,过滤后,得到沉淀X和滤液Y.下列叙述正确的是( )
A.该混合粉末从组成看,其成分皆是碱性氧化物
B.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+
C.沉淀X的成分是SiO2
D.在溶液Y中加入过量的氨水,过滤得到的沉淀的成分是Fe(OH)3和Mg(OH)2
难度: 简单查看答案及解析
-
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流
程如下:
已知:卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
下列说法不正确的是 ( )
A.卤块中加入KMnO4发生的氧化还原反应有2个
B.加入BaCl2为沉淀SO42-
C.也可用Mg(OH)2代替MgO调节溶液的pH
D.在滤液中加NaClO3饱和溶液得到产品利用了相同温度下,Mg(ClO3)2溶解度比NaClO3的溶解度小
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B.向Na2SiO3溶液中通入过量SO2:SiO32-+
SO2+ H2O=H2SiO3↓+SO32-
C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+4NH4++2H2O
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+ O2↑
难度: 简单查看答案及解析
-
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后
=11,则溶液中
=
B.参加反应的氯气的物质的量等于
a mol
C.改变温度,反应中转移电子的物质的量n
e的范围:
a mol≤ne≤
a mol
D.改变温度,产物中KClO3的最大理论产量为
a mol
难度: 中等查看答案及解析
-
下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、Cr2O72-、SO42-
B.Ca2+、H+、SO42-、HCO3-
C.Na+、Cu2+、Cl-、S2-
D.Fe3+、K+、SCN-、Cl-
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.为除去FeCl2溶液中少量的FeCl3,可加入过量铁粉,再过滤
B.明矾中Al3+水解产生具有吸附性的胶体,明矾可用于自来水的净化
C.为除去CO2中少量的HCl,可使其通过饱和的Na2CO3溶液
D.为除去KCl溶液中少量的MgCl2,可加入适量KOH溶液,再过滤
难度: 中等查看答案及解析
-
某饱和溶液中含有三种阳离子:Cu2+、Ba2+、Al3+,同时测知此溶液中pH=3,则该溶液所含有的阴离子可以是下列中的( )
A.CO32- B.SO42- C.Cl- D.S2-
难度: 中等查看答案及解析
-
下列叙述不正确的 ( )
A. 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B. 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
C. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D. 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
难度: 简单查看答案及解析
-
仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的--( )
选项
实验目的
仪器
A
除去氯化钠溶液中的泥沙
漏斗(带滤纸)、烧杯、玻璃棒
B
从食盐水中获得NaCl晶体
坩埚、玻璃棒、酒精灯、泥三角
C
用0.10 mol·L-1的盐酸测定未知浓度的NaOH溶液浓度
碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯
D
用MnO2和浓盐酸制取干燥、纯净的Cl2
圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网
难度: 简单查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要
存在的一组离子正确的是 ( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe3+、NH4+、SO42-、OH-
D.加入过量NaClO溶液和NaOH溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 困难查看答案及解析
-
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为---( )
A.0.2 mol B.0.4 mol C.0.8 mol D.0.9 mol
难度: 困难查看答案及解析