-
大多数碳的化合物都是共价化合物,其原因是( )
A.碳原子最外电子层有4个电子 B.碳元素是非金属元素
C.碳有多种同素异形体 D.碳元素有三种同位素
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.pH小于7的雨水称为酸雨
B. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
C. O3可用于游泳池的杀菌消毒
D. 黄铜是纯铜,青铜是合金
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
难度: 中等查看答案及解析
-
右表为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中,正确的是( )
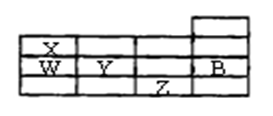
A.常压下,五种元素的单质中,Z单质的沸点最高
B.W的氢化物比X的氢化物的稳定性高
C.Y、Z的阴离子电子层结构都与B原子的相同
D.Y元素比W元素的非金属性强
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.铜溶于浓硝酸: Cu +4HNO3 (浓) = Cu2+ + 2NO2↑+2H2O
B.硫酸铁溶液与氢氧化钡溶液混合:Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓
C.次氯酸钙溶液中通入过量的CO2: ClO—+H2O+CO2=HCO3—+HClO
D.碳酸氢镁与足量的石灰水反应:Mg2++2HCO3—+2OH—+Ca2+=CaCO3↓+MgCO3↓+2H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.64 g铜与足量浓硫酸完全反应,转移电子数小于2NA个
B.22.4 L水含有NA个H2O分子
C.22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.20g D2O 中含有的电子数为10NA
难度: 中等查看答案及解析
-
钾和另一碱金属组成的混合物5.2g 与水完全反应时放出氢气2.24L(标况),则另一碱金属一定是( )
A.Na B.Rb C.Cs D.Fr
难度: 中等查看答案及解析
-
某课外实验小组设计的下列实验合理的是( )


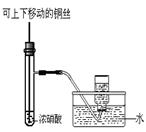

A. 配制一定浓度硫酸溶液
B. 制备少量氨气
C. 制备并收集少量NO2气体
D. 制备少量氧气
难度: 中等查看答案及解析
-
在氯化钡溶液中通入SO2,溶液仍澄清,若将氯化钡溶液分装入两试管中,一支通氯气,另一支加烧碱溶液,然后再通入SO2,结果两试管都有有白色沉淀。由此得出的下列结论合理的是( )
A.氯化钡具有两性
B.SO2有还原性和酸性
C.两支试管内白色沉淀均是亚硫酸钡
D.氯化钡溶液中通入SO2 后溶液仍澄清的原因是由于SO2过量,生成了亚硫酸氢钡
难度: 中等查看答案及解析
-
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是()
A.Al B.Al(OH)3 C.Al Cl3 D.Al2O3
难度: 中等查看答案及解析
-
在相同条件下,有4支试管盛有等体积混合的4种混合气体,它们分别是 ①NO2和NO②NO2和O2③NH3和N2④H2和NO,现将4支试管均倒扣于水中,充分反应后,水面上升高度依次为a、b、c、d其关系正确的是( )
A.a=b=c=d B.c>b>a>d C.b>c>a>d D.a>b>c>d
难度: 中等查看答案及解析
-
已知
在酸性溶液中易被还原成
的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
对下列物质 ①氢硫酸 ②亚硫酸钠溶液 ③氯水 ④硫酸亚铁溶液 ⑤氢氧化钠溶液,只需观察试剂瓶内的情况就可作出该试剂是否变质结论的是( )
A.①②③ B.①②⑤ C.①③④ D.①②③④⑤
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. MgSO4晶体中只存在离子键
B.CH4、CO2 都是由极性键构成的
C.碱金属位于周期表中ⅠA主族,其密度均小于水
D.次氯酸的结构式:H—Cl—O
难度: 中等查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

据此,下列说法正确的是 ( )
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1molZn与足量的该硫酸反应产生2g氢气
C.配制200mL4.6 mol·L-1 的稀硫酸需取该硫酸50mL
D.该硫酸与等质量的水混合后所得溶液的物质的量浓度大于9.2 mol·L-1
难度: 中等查看答案及解析
-
欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂 ①Cl— ②SO42— ③OH— ④CO2 ⑤CO32—的正确顺序是( )
A.①②③④ B.③⑤①②
C.②①③⑤ D.①⑤③②
难度: 中等查看答案及解析
-
已知
与足量的10 mol/L硫酸混合微热,产生下列现象: ①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色 据此判断下列说法正确的是( )
A.反应中硫酸作氧化剂
B.
中硫元素被氧化
C.刺激性气味的气体是氨气
D.1 mol
完全反应转移0.5 mol电子
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.高纯度的二氧化硅可用于制造计算机芯片和太阳能电池
B.胶体和溶液可以通过滤纸进行分离
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
难度: 中等查看答案及解析
-
是一种高效多功能水处理剂。一种制备
的方法可用化学方程式表示如下:
↑,下列说法中不正确的是( )
A.
在上述反应中只作氧化剂
B.
既是氧化产物又是还原产物
C.
处理水时,既能杀菌,又能在处理水时产生胶体净水
D.2 mol
发生反应时,共有10 mol电子发生转移
难度: 中等查看答案及解析
-
由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够支持这个结论的是( )
A.已经制得了I2O5等碘的氧化物
B.在IBr、ICl等卤素互化物中碘元素表现正价
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等离子化合物
D.碘(I2)易溶于KI等碘化物的溶液,形成I
难度: 中等查看答案及解析