-
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol•L-1戊溶液中阴离子总的物质的量小于0.1mol难度: 中等查看答案及解析
-
下列实验中,依据实验操作及现象,得出的结论正确的是( )
操作 现象 结论 A 用CH3COOH溶液浸泡水垢 水垢溶解,有无色气泡 碱性:NaHCO3>CH3COONa
B测定等浓度的Na2CO3和Na2SO3溶液的pH 前者pH比后者的大 非金属性:S>C C 向FeBr2溶液中通入过量Cl2 溶液由浅绿色变成黄色 氧化性:Br2>Fe3+ D 向盛有1mL 0.1mol•L-1 AgNO3溶液的试管中滴加2~4滴0.1mol•L-1 NaCl溶液,后继续滴加 0.1mol•L-1 KI溶液. 出现黄色沉淀 溶解度:AgCl>AgI
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( )
A.暖冰中水分子是直线型分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.暖冰中水分子的各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为2:1的是( )
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积
B.相同温度下,pH=1与pH=2的硫酸溶液中的c(H+)
C.在过氧化钠固体中,阳离子和阴离子的个数
D.在碳与浓硫酸(加热)的反应中,参加反应的H2SO4与被还原的H2SO4的物质的量难度: 中等查看答案及解析
-
下列说法正确的是( )
A.溶液中c(H+)>c(OH-),该溶液不一定显酸性
B.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可制备Fe(OH)3胶体
C.主族元素的简单离子R2-和M+的电子层结构相同,则原子序数R>M
D.若相同温度和浓度的两种酸的酸性HA>HB,则钠盐溶液的碱性NaA<NaB难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.在分子中,两个成键的原子间的距离叫键长
B.含有极性键的分子一定是极性分子
C.键能越大,表示该分子越容易受热分解
D.H-Cl的键能为431.8KJ•mol-1,H-I的键能为298.7KJ•mol-1,这可说明HCl分子比HI分子稳定难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
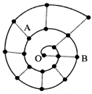
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B两种元素组成的化合物中可能含有共价键难度: 中等查看答案及解析
-
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2.根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性
B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS
D.溶解度小于CuS、PbS、CdS难度: 中等查看答案及解析
-
下列说法正确的是( )
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.处于最低能量的原子叫做基态原子
C.硫离子的结构示意图为:
D.基态碳原子的电子排布图:难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
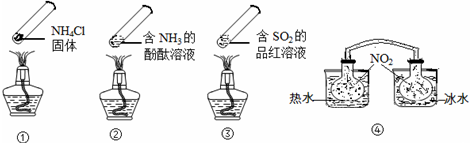
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应难度: 中等查看答案及解析
-
下列各装置中都盛有0.1mol•L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的顺序是( )

A.③①④②
B.①②④③
C.①②③④
D.②①④③难度: 中等查看答案及解析
-
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸.
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.⑤⑦⑧难度: 中等查看答案及解析
-
向1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则图中比较符合客观事实的是( )
A.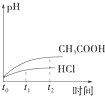
B.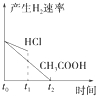
C.
D.
难度: 中等查看答案及解析
-
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4混合溶液,已知溶液中n(AlCl3):n(CuSO4)=1:12,
t1时刻a电极得到混合气体,其中Cl2在标准状况下为224mL(忽略气体的溶解);t2时刻Cu全部在电极上析出.下列判断正确的是( )
A.电解过程中,溶液的pH不断增大
B.t2时,两电极的质量相差5.12 g
C.a电极与电源的负极相连
D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑难度: 中等查看答案及解析
-
在密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断正确的是( )
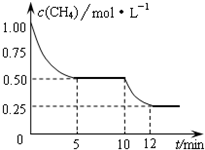
A.10 min时,改变的外界条件可能是减小压强
B.0~5 min内,v(H2)=0.1 mol/
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12 min时,反应达平衡时,气体的平均摩尔质量不再变化难度: 中等查看答案及解析
-
如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
Na2S4+3NaBr.闭合开关K时,b极附近先变红色.下列说法正确的是( )
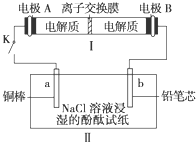
A.负极反应为4Na-4e-=4Na+
B.当有0.01 mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112 mL
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有气体产生难度: 中等查看答案及解析