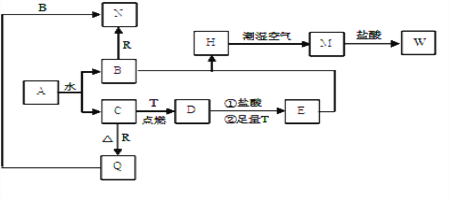
-
分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A. 既有单质参加又有单质生成的反应一定是氧化还原反应
B. 淀粉、纤维素、油脂均属于天然高分子
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
难度: 困难查看答案及解析
-
将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A.
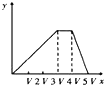 B.
B. 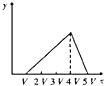
C.
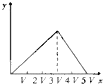 D.
D. 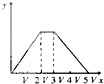
难度: 困难查看答案及解析
-
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32—+O2+x M===Fe3O4+S4O62—+2H2O,有关说法正确的是 ( )
A. 每转移3mol电子,有1.5mol Fe2+被氧化
B. M为OH—离子,x=2
C. O2、S2O32—都是氧化剂
D. 每生成1molFe3O4,反应中转移2mol电子
难度: 困难查看答案及解析
-
黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
难度: 困难查看答案及解析
-
在100mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol/L.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
难度: 困难查看答案及解析
-
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )

A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
难度: 简单查看答案及解析
-
1.52g铜镁合金完全溶解于5mL 14mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g 沉淀.下列说 法不正确的是
A. 该合金中铜与镁的物质的量之比是2:l
B. 得到2.54g 沉淀时,加入NaOH 溶液的体积是600mL
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 与铜镁合金反应的HNO3的物质的量为0.12mol
难度: 困难查看答案及解析
-
将13.6gCu和Cu2O组成的混合物加入250ml一定浓度的稀硝酸中,固体完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0L0.5mol•L-1的NaOH溶液,生成沉淀的质量为19.6g,此时溶液呈中性,且金属离子沉淀完全。下列说法正确的是 ( )
A. 原固体混合物中,Cu和Cu2O的物质的量之比为1∶1 B. 原稀硝酸的浓度为1.3mol·L-1
C. 产生的NO的体积为2.24L D. 反应后剩余硝酸的物质的量为0.1mol
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是
A. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
B. 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C. 用铜做电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
难度: 困难查看答案及解析
-
某温度下,物质X2SO4的饱和溶液密度为ρg·mL-1,c(X+)= c mol·L-1,溶质的质量分数为a%,溶质的摩尔质量为Mg·mol-1,溶解度为S g,下列表达式正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4,下列说法错误的是
A. 若0.5molNa2S2O3作还原剂,则转移4mol电子
B. 当Na2S2O3过量时,溶液能出现浑浊
C. 氧化产物、还原产物的物质的量之比为1∶1
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
难度: 困难查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B. 1mol Na2O2与足量CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D. 0.1 mol H2和0.1 molI2于密闭容器中充分反应后,HI分子总数为0.2NA
难度: 困难查看答案及解析