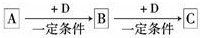-
A、B、C、D、E五种主族元素原子序数逐渐增大,且均不超过18,其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等.下列说法正确的是( )
A.A与E形成的化合物为离子化合物
B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D
D.最高价氧化物对应水化物的碱性:C>D难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.明矾净水的原理和“84”消毒液消毒的原理相同
C.为了减小对环境的污染,火力发电厂对燃煤进行脱硫脱硝处理
D.SO2和NO2都能使雨水的pH<5.6,造成酸雨难度: 中等查看答案及解析
-
分类是化学研究中常用的方法.下列分类方法正确的是( )
A.根据溶液酸碱性,将化合物分为酸、碱、盐
B.根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液
C.根据化合物是否来自于有机体,将化合物分为有机物和无机物
D.根据溶液导电性强弱,将电解质分为强电解质和弱电解质难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 L0.1 mol•L-1的Na2CO3溶液中含CO32-为0.1NA
B.标准状况下,22.4 L SO3含SO3分子数为NA
C.1mol H3O+含质子数为10 NA
D.1molNa2O和Na2O2混合物中含阴离子的总数为NA难度: 中等查看答案及解析
-
若M是ⅡA族的某元素,则与M同周期且相邻的元素不可能位于元素周期表的( )
A.ⅠA
B.ⅠB
C.ⅢA
D.ⅢB难度: 中等查看答案及解析
-
除去下列物质中所含少量杂质的所选试剂不正确的是( )
物 质 杂 质 试 剂 A Cl2 HCl 饱和食盐水 B CO2 HCl 饱和Na2CO3溶液 C 金属镁 金属铝 稀NaOH溶液 D FeCl2 FeCl3 铁粉
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列各组物质反应的生成物中只有一种气体(常温常压)的是( )
A.足量铜和浓硝酸反应
B.碳和浓硫酸共热
C.碳酸氢铵和足量氢氧化钠共热
D.电解饱和食盐水难度: 中等查看答案及解析
-
下列操作或仪器的选用正确的是( )
A.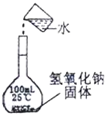
配制100ml1mol/L的NaOH溶液
B.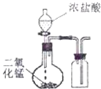
制取并收集CI2
C.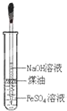
制备Fe(OH)2
D.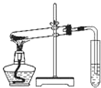
探究NaHCO3的热稳定性难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.硝酸银溶液中加入铜粉:Cu+Ag+=Cu2++Ag
B.AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
C.稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O难度: 中等查看答案及解析
-
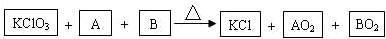
反应:Cr2O72-+3SO32-+aH+=2Cr3++3Y+4H2O下列说法不正确的是( )
A.Y是SO42-
B.a=8
C.Cr2O72-被氧化成Cr3+
D.生成1molCr3+时转移的电子数是3×6.02×1023难度: 中等查看答案及解析
-
往100ml 1mol•L的Al2(SO4)3 溶液中加入100ml 4mol•L Ba(OH)2溶液,最终得到沉淀的质量是( )
A.15.6g
B.69.9g
C.93.2g
D.85.5g难度: 中等查看答案及解析
-
A、B、C、M是四种中学化学常见的物质,它们之间的转化关系如图所示,A和M不可能是( )
A.NaAlO2溶液和盐酸
B.Fe和Cl2
C.SO2和NaOH溶液
D.NH3和O2难度: 中等查看答案及解析
-
在无色溶液中一定能大量共存的离子组是( )
A.K+、Ca2+、Cl-、SO42-
B.K+、AlO2-、Cl-、CO32-
C.Na+、OH-、MnO4-、HCO3-
D.H+、Fe2+、SO42-、ClO-难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标况)气体,所得溶液加KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的混合物,能得到铁( )
A.11.2g
B.2.8g
C.5.6g
D.无法计算难度: 中等查看答案及解析