-
NA表示阿伏加德罗常数,下列说法中正确的是
①等物质的量的N2和CO所含分子数均为NA
②常温下,4g CH4含有NA个C-H共价键
③1 mol Na2O2与水完全反应时转移电子数为2NA
④将NA个NH3分子溶于1 L水中得到1 mol·L-1的氨水
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
A.①③⑤ B.②⑤ C.②④⑥ D.②③⑤
难度: 困难查看答案及解析
-
人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是
A.铁、金属活动性顺序表 B.金、质量守恒定律
C.银、元素周期律 D.铜、金属密度顺序表
难度: 中等查看答案及解析
-
下列广告语对应商品中含有的物质有误的是
A.“红梅味精,领先(鲜)一步”--蛋白质
B.“衡水老白干,喝出男人味”——乙醇
C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙
D.“要想皮肤好,早晚用大宝”——丙三醇
难度: 简单查看答案及解析
-
下列实验操作能达到目的的是
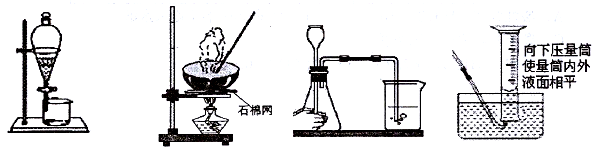
A.分离碘酒中的碘 B.蒸发 C.检查装置气密性 D.读取气体体积
难度: 中等查看答案及解析
-
已知短周期元素的四种离子:aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则下列叙述中正确的是
A、原子序数 d>c>b>a
B、单质的还原性D<C<B<A
C、离子半径 C3—>D—>B+>A2+
D、A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A
难度: 中等查看答案及解析
-
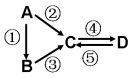
分别用等量的铁与足量的稀硫酸和足量的CuO制备单质铜,有人设计了以下两种方案:
①
 ,②
,②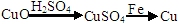 。对制备得到Cu的量,下列判断正确的是
。对制备得到Cu的量,下列判断正确的是A.一样多 B.①多 C.②多 D.无法判断
难度: 中等查看答案及解析
-
限定使用以下物质,盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、醋酸、稀硫酸。则符合
2H++CO32-=CO2↑+2H2O这个离子方程式的化学方程式共有
A.15个 B.12个 C.9个 D.6个
难度: 中等查看答案及解析
-
人造空气(氧气O2与氦气He的混合气)可用于减轻某些病痛或供深水潜水员使用。在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气的质量比是
A. 1:1 B. 1∶4 C. 2: 1 D.2:3
难度: 中等查看答案及解析
-
已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S元素的化合价是
A.2, +6 B.2, +7 C.4 ,+6 D.4 , +7
难度: 困难查看答案及解析
-
下列物质中属于纯净物的一组是
①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥漂白粉 ⑦二甲苯 ⑧TNT
⑨溴苯 ⑩C5H10 ⑪含氧40%的氧化镁 ⑫花生油 ⑬福尔马林 ⑭密封保存的NO2气体
A.①⑧⑨⑪ B.②③④⑥ C.⑦⑩⑫⑬⑭ D.①④⑧⑨⑪⑫
难度: 中等查看答案及解析
-
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
A.只有AgBr沉淀生成
B. AgCl和AgBr沉淀等量生成
C. AgCl沉淀少于AgBr沉淀
D. AgCl沉淀多于AgBr沉淀
难度: 中等查看答案及解析
-
苯的同系物C12H18有多种同分异构体,其中二取代苯的同分异构体(不考虑立体异构)有
A.48种 B.45种 C.42种 D.以上都不是
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、S2-
A.①③⑤ B.②④ C.②⑤⑥ D.④⑤
难度: 困难查看答案及解析
-
下列排列顺序完全正确的组合是
①溶解性:Na2CO3>NaHCO3>MgCO3>Mg(OH)2
②等浓度的下列盐溶液的pH关系:NaAlO2>NaHCO3>NaClO
③常温下,以a1、a2、a3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则a1=a2>a3
④同温下,1L0.5mol/L NH4Cl溶液中n(NH4+)与2L 0.25mol/LNH4Cl溶液中n(NH4+),分别为a、b,则a>b
⑤热稳定性:H2O>H2Se>H2S
⑥半径:Cl->O2->Al3+;F<Si<Na
⑦氧化性:MnO2>Cl2>Fe3+>Cu2+
⑧沸点:金刚石>氯化钠>干冰>冰醋酸
A.①②③④⑥ B.①③④⑥⑦⑧ C.②⑤⑧ D.①④⑥⑦
难度: 困难查看答案及解析
-
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是
A.反应②中的能量变化如图所示,则ΔH2=E1-E3

B.H2的燃烧热为241.8 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
难度: 困难查看答案及解析
-
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O
2H++ 2CrO42- (黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+
2Cr3+(绿色) + 6Fe3+ + 7H2O。下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72- > Fe3+
C. CrO42- 和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
难度: 困难查看答案及解析
-
一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g)+I2(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g)发生反应HI(g)
H2(g)+
I2(g),则下列判断正确的是
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol·L-1
难度: 困难查看答案及解析
-
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)
0.1 mol/L
难度: 中等查看答案及解析
-
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
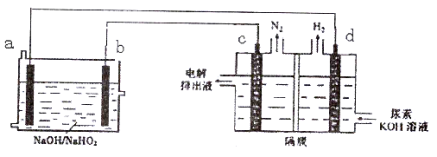
A.燃料电池的总反应为:2Al+3HO2- = 2AlO2- + 2H2O
B.电解时,Al消耗2.7g,则产生氮气的体积为1.12L
C.电极b是负极,且反应后该电极区pH增大
D.电解过程中,电子的流向由a→d,c→b。
难度: 困难查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
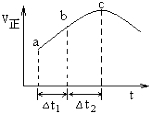
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段大于b~c段
难度: 困难查看答案及解析