-
NA为阿伏加德罗常数的数值,下列说法中正确的是
A.常温下28g乙烯中所含极性键的数目为4NA
B.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+
C.标准状况下,22.4L甲醇中所含羟基数为NA
D.10L pH=1的硫酸溶液中含有的H+离子数为2NA
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的粒子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.常温下,
=0.001 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
C.常温下由水电离出来的c(H+)=1.0×10 -13mol·L-1溶液中:AlO2-、K+、SO42-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、4+、NO3-
难度: 中等查看答案及解析
-
某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
A.9 B.6 C.5 D.4
难度: 中等查看答案及解析
-
某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是
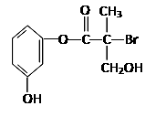
A.该有机物与浓溴水可发生取代反应
B.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C.该有机物与浓硫酸混合共热可发生消去反应
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
难度: 困难查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作
实验目的或结论
A
向CuSO4溶液中通入H2S气体,出现黑色沉淀
H2S的酸性比H2SO4强
B
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
除去MgCl2溶液中少量FeCl3
C
蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀
蔗糖未水解
D
C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液
检验制得气体是否为乙烯
难度: 困难查看答案及解析
-
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
难度: 困难查看答案及解析
-
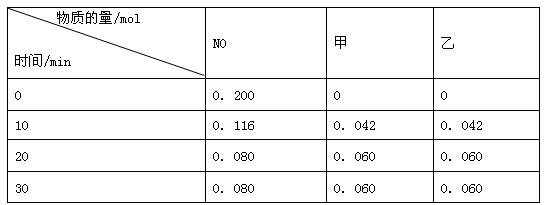
在一个恒容绝热的密闭容器中,发生可逆反应: M(?) + 2N(g)
P(g) + Q(g) △H>0 ,已知M的状态未知,则下列描述一定达到平衡的标志是
①当物质M、N、P的体积分数比为 1 : 1 : 1时
②混合气体的密度不变时
③体系的温度不变时
④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时
⑥气体的平均相对分子质量不变时
A.①③④ B.③⑤⑥ C.②③⑥ D.③④⑤
难度: 困难查看答案及解析