-
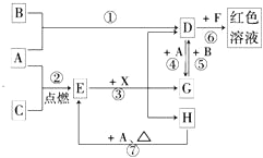
在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水。以下叙述正确的是 ( )
A. 铝热剂就是单指Fe2O3粉和铝粉的混合物
B. 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C. 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3:2:3
D. 明矾属硫酸盐,含结晶水,是混合物
难度: 中等查看答案及解析
-
下列化合物中不能由化合反应直接得到的是( )
A. FeS B. Fe(OH)3 C. FeCl3 D. Al(OH)3
难度: 中等查看答案及解析
-
以下物质属于纯净物的是( )
A. 硬铝 B. 漂白粉 C. 绿矾 D. 铝热剂
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A. 质子数相同的原子,其核外电子排布也相同
B. 质量数相同的不同原子,其化学性质一定相同
C. 金属性越强,其原子在反应中越容易失去电子
D. 非金属性越强,其阴离子反应中越容易失去电子
难度: 简单查看答案及解析
-
把一块生锈的铁片投入盛有稀硫酸的烧杯里,待铁片完全溶解后,往烧杯里滴加氢氧化钠溶液至过量, 然后过滤,并充分灼烧不溶物。则最终留下的固体是( )
A. Na2O B. Fe(OH)3 C. Fe2O3 D. Fe2O3 和 NaOH
难度: 中等查看答案及解析
-
Al、Fe 都是重要的金属元素,下列说法正确的是( )
A. 两者对应的氧化物均为碱性氧化物
B. 两者的单质都不能与氢氧化钠溶液反应
C. 常温条件下,两种金属都能溶解于浓硫酸中
D. 制备 AlCl3、FeCl3,均不能采用将其溶液直接蒸干的方法
难度: 困难查看答案及解析
-
X、Y、Z均为短周期主族元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A. 原子序数:X>Y>Z B. 气态氢化物的稳定性:H2X>HZ
C. 离子半径:X2->Y+>Z- D. 原子最外层电子数:Y>X>Z
难度: 困难查看答案及解析
-
下列离子方程式表达正确的是( )
A. 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓
B. 将铁粉加入到稀硫酸种:2Fe+6H+=2Fe3++3H2↑
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
D. NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
下列微粒性质递变正确的是( )
A. 原子半径:C、A1、Na、K依次增大
B. 离子半径:O2-、F-、A13+、Mg2+、Na+ 依次减小
C. 热稳定性:HF、NH3、PH3、SiH4 依次增强
D. 非金属性:Si、P、S依次减弱
难度: 中等查看答案及解析
-
甲乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol/LA1C13 溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A. 甲中沉淀一定比乙中多 B. 乙中沉淀可能比甲中的多
C. 甲中沉淀一定比乙中的少 D. 甲中和乙中的沉淀可能一样多
难度: 中等查看答案及解析
-
由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
难度: 困难查看答案及解析
-
两种短周期元素 X 和 Y 形成的单质能与氢气反应生成 HX 和 HY,反应热分别为 Q1 和 Q2,已知 Q1> Q2,则判断一定正确的是( )
A. 沸点:HY>HX B. 还原性:HY>HX
C. 稳定性:HY>HX D. 酸性:HXO4>HYO4
难度: 中等查看答案及解析
-
在含有Fe2+、Fe3+、A13+、NH4+的溶液中加入足量Na2O2固体,充分反应后,再加入过量稀盐酸,反应完全后离子数目没有明显变化的是( )
A. Fe3+ B. Fe2+ C. A13+ D. NH4+
难度: 简单查看答案及解析
-
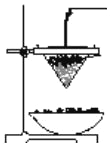
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
① ② ③ ④
A. ①②③ B. ①②④ C. ①②③④ D. ②③④
难度: 中等查看答案及解析
-
将mg镁铝合金投入到500 mL 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L (标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为( )
A. 5.10 B. 8.50
C. 9.35 D. 11.48
难度: 困难查看答案及解析
-
能与铝作用放出氢气的溶液中,可能大量共存的离子组是( )
A. NH4+、Mg2+、NO3-、Cl- B. Cu2+、Na+、HCO3-、Br-
C. Na+、Fe2+、SO42-、NO3- D. K+、Na+、AlO2-、Cl-
难度: 困难查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是()
A. X的原子半径一定大于Y的原子半径
B. X与Y的简单离子不可能具有相同的电子层结构
C. 两元素形成的化合物中,原子个数比不可能为1︰1
D. X2Y可能是离子化合物,也可能是共价化合物
难度: 简单查看答案及解析
-
向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )
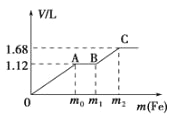
A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 mol•L-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
难度: 中等查看答案及解析