-
下列化学与生活的相关叙述正确的是
A.NO2、CO2和SO2都是大气污染物
B.用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯以达到保鲜的要求
C.石油裂解和油脂皂化都是高分子生成小分子的过程
D.馒头、米饭在口腔内越嚼越甜,是因为它们含有的淀粉发生了酯化反应
难度: 简单查看答案及解析
-
能在水溶液中大量共存的一组离子是
A.H+、Ca2+、I-、NO3- B.Al3+、Mg2+、SO42-、CO32-
C.NH4+、Na+、Br-、SO42- D.K+、Fe2+、OH-、HCO3-
难度: 中等查看答案及解析
-
设nA为阿伏加德罗常数,下列说法正确的是
A.常温下,28g C2H4含nA个碳碳双键
B.1 mol Cu和足量稀硝酸反应生成nA NO分子
C.常温常压下,22.4L CCl4含有n A个CCl4分子
D.1mol/L NaCl溶液含有n A个Na+
难度: 中等查看答案及解析
-
对于常温下PH=10的氨水,下列说法正确的是
A.该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1
B.该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同
C.降低温度,溶液的c(NH4+)/ c(NH3·H3O)减小,PH降低
D.往该溶液中加入足量的NH4Cl固体后,c(NH4+) + c(NH3·H3O)= c(Cl-)
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
SO2有氧化性
SO2可用于漂白纸浆
B
高纯单质硅有良好的半导体性能
高纯单质硅可用于制光电池
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
明矾能净水生成Al(OH)3胶体
明矾可用作生活用水的消毒剂
难度: 中等查看答案及解析
-
下列装置或操作不能达到实验目的的是
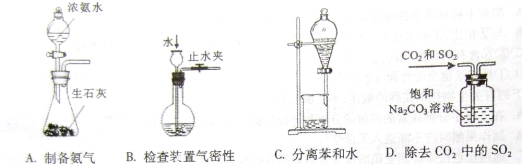
难度: 简单查看答案及解析
-
(双选)下列根据实验和现象所得出的结论正确的是
选项
实验
现象
结论
A
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
B
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液
出现白色沉淀
溶液X中一定含有SO42-
C
向一定浓度的Na2SiO3溶液中通入适量CO2气体
出现白色胶状物
酸性:H2SiO3<H2CO3
D
向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
KSP(AgCl) > KSP(AgI)
难度: 困难查看答案及解析
-
(双选)短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中Y所处的周期序数与族序数相等。W最外层电子数是内层电子数的3倍。下列说法正确的是
…
W
X
Y
…
Z
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的稳定性小于Z的气态氢化物的稳定性
D.W与Y形成的化合物可分别与NaOH溶液和盐酸反应
难度: 中等查看答案及解析