-
气体分子中的极性键在红外线的照射下,易像弹簧一样作伸缩和弯曲运动,从而产生热量。下列气体不属于温室效应气体的是
A.CO2 B.N2O C.CH4 D.N2
难度: 中等查看答案及解析
-
在单质的晶体中,一定不存在
A.离子键 B.分子间作用力 C.共价键 D.金属键
难度: 中等查看答案及解析
-
下列反应中,既属于离子反应,又属于有颜色变化的氧化还原反应的是。
A.FeCl3溶液和KSCN溶液混合 B.锌放入稀硫酸中
C.铜片放入氯化铁溶液中 D.硫酸铜溶液与氢氧化钠溶液混合
难度: 中等查看答案及解析
-
下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
D.硫酸厂厂址的选择应靠近原料产地
难度: 中等查看答案及解析
-
下列分散系中能发生丁达尔效应的是
A.生理盐水 B.碘酒 C.淀粉溶液 D.医用酒精
难度: 中等查看答案及解析
-
下列晶体熔化时,化学键没有被破坏的是
A.氯化铵 B.金刚石 C.冰醋酸 D.硫酸钠
难度: 中等查看答案及解析
-
电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的
A.NaOH B.NaCl C.HCl D.CuSO4
难度: 中等查看答案及解析
-
下列说法中正确的是
A.含有离子键的化合物一定是离子化合物
B.所有物质中都存在化学键
C.含有极性键的分子一定是极性分子
D.氢键是一种强度介于离子键和共价键之间的化学键
难度: 中等查看答案及解析
-
下列电子式书写错误的是

难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A.少量铁粉加入稀硝酸中:
3Fe + 8H+ + 2NO3-=3Fe2+ + 2NO↑+ 4H2O
B.Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:
Ca2+ + HCO3- + OH-=CaCO3↓+ H2O
C.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:
Fe3++3H2O
Fe(OH)3(胶体)+3H+
D.Na2S溶液中通入足量H2S:S2-+ H2S=2HS-
难度: 中等查看答案及解析
-
用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了mg,则
A.电解液质量增加mg B.阴极质量增加xg,x>m
C.阴极质量增加mg D.阴极质量增加yg,y<m
难度: 中等查看答案及解析
-
能大量共存于同一溶液中,且当水电离c(H+)=10-13mol/L时,又能发生反应的离子组是
①Na+、Ba2+、C1—、HCO3— ②K+、NH4+、CH3COO—、SO42—
③Ca2+、NH4+、SO42—、SO32— ④Fe3+、Na+、SCN—、C1—
⑤A13+、Na+、HCO3—、NO3—
A.只有① B.②③ C.①④ D.①②
难度: 中等查看答案及解析
-
甲烷是一种高效清洁的新能源,0.25 mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l); ΔH== +890 kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l); ΔH== +890 kJ·mol-1
C.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l); ΔH== -890 kJ·mol—1
D.CH4(g) + 2O2(g) == CO2(g) +2H2O(l); ΔH== -890 kJ·mol—1
难度: 中等查看答案及解析
-
如图中,两电极上发生的电极反应为:
a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是
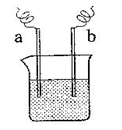
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
难度: 中等查看答案及解析
-
下图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子。已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为
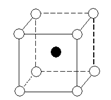

难度: 中等查看答案及解析