-
25℃时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),设反应后溶液的pH如下表:
实验编号
起始浓度/mol·L—1
反应后溶液的pH
c(H2A)
c (NaOH)
①
x
0.10
9
②
0.10
0.10
5
下列判断不正确的是
A. x﹤0.10
B. HA—的电离程度大于水解程度
C. 实验②所得溶液:c(Na+)=c(A2—)+c(HA—)+c(H2A)
D. 将实验①所得溶液加水稀释后,c(A2—)/c(HA—)变大
难度: 困难查看答案及解析
-
有一种“水”电池,在海水中电池总反应可表示为行发电,在海水中电池总反应可表示为: 5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是:
A. 正极反应式:Ag+Cl--e-=AgCl B. Na+不断向“水”电池的正极移动
C. 每生成1molNa2Mn5O10转移2mol电子 D. AgCl是还原产物
难度: 困难查看答案及解析
-
下列依据相关实验得出的结论正确的是
A. 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B. 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C. 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
D. 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2
难度: 困难查看答案及解析
-
下列有关有机物的说法正确的是( )
A. 乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B. 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C. 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
D. 有机物分子式为C4H7ClO2,与NaHCO3溶液反应产生CO2,其结构可能有15种
难度: 困难查看答案及解析
-
铜与一定量的浓硝酸反应,铜耗完时,生成硝酸铜溶液和NO、NO2 和N2O4的混合气体,这些气体与5.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,则所消耗的铜的质量为( )g
A. 3.2 B. 64 C. 32 D. 12.8
难度: 困难查看答案及解析
-
对下列事实的解释正确的是( )
A. 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B. 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应盛放
C. 向50mL18mol•L -1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D. 向某溶液中加入BaCl2溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液不一定含有SO42-
难度: 困难查看答案及解析
-
已知Am+ Bn+ Cm- Dn-具有相同的核外电子排布,(已知m>n)则下列说法正确的是( )
A. 原子序数C>D>A>B B. 原子半径B>A>D>C
C. 离子半径 Cm- > Dn-> Bn+ >Am+ D. D一定是第二周期元素
难度: 困难查看答案及解析
-
在实验室中,下列除去杂质的方法正确的是 ( )
A. 硝基苯中混有的少量硫酸和硝酸,将其倒入盛有NaOH溶液的分液漏斗中,振荡,静置,分液
B. 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷
C. 溴苯中混有溴,加入KI 溶液,振荡,用汽油萃取出碘
D. 乙烯中混有SO2和CO2,将其通入溴水中洗气
难度: 困难查看答案及解析
-
有一种有机化合物,其结构简式如右图,下列有关它的性质的叙述,正确的是
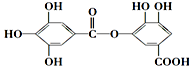
A. 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2
B. 在一定条件下,1mol该物质最多能与7mol NaOH完全反应
C. 在Ni催化下,1mol该物质可以和8mol H2发生加成反应
D. 它能发生水解反应,水解后只能生成两种产物
难度: 困难查看答案及解析
-
下列关于
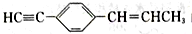 的说法中不正确的是
的说法中不正确的是A. 最多只有5个碳原子在同一直线上 B. 最多有11个碳原子在同一平面上
C. 有7个碳原子可能在同一直线上 D. 最多有19个原子在同一平面上
难度: 困难查看答案及解析
-
取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A. 3.6mol/L B. 3.2mol/L C. 2.8mol/L D. 2.4mol/L
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A. 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
B. 0.1 mol·L-1 NH4Cl 溶液与 0.1 mol·L-1 氨水等体积混合(pH>7):c(NH3 ·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)=c(Br-)
D. 向 0.10 mol·L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+) = 2c(SO32-)+c(HSO3-)
难度: 困难查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )
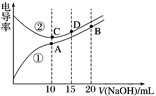
A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
难度: 困难查看答案及解析
-
C8H8O2符合下列要求的同分异构体数目是( )
①属于芳香族化合物 ②能与新制氢氧化铜溶液反应 ③能与氢氧化钠溶液反应
A. 10种 B. 21种 C. 14种 D. 17种
难度: 困难查看答案及解析
-
在一定的温度下,向一个容积为2 L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2, 3min后测得密闭容器内的压强是起始时的0.9倍。在这段时间内,用H2表示该反应的平均反应速率是
A. 0.125mol·L-1·min-1 B. 0.100 mol·L-1·s-1
C. 0.200 mol·L-1·min-1 D. 0.375 mol·L-1·s-1
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增加。X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体。上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中正确的是( )
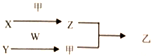
A. 原子半径:D>C>B>A
B. C. D的氢化物均为共价化合物
C. 相对分子质量W>X,沸点W>X
D. B的氢化物常温下一定为气态,C的氢化物常温下为液态
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A. 碳酸氢铵溶液与少量氢氧化钠溶液:NH
+HCO
+2OH-===NH3·H2O+CO
+H2O
B. 氯化铵溶液中加入少量稀氢氧化钠溶液:NH
+OH-===NH3↑+H2O
C. 氨水与盐酸反应:NH3·H2O+H+===NH
+H2O
D. 氨水中通入过量二氧化碳:2NH3·H2O+CO2===2NH
+CO
+H2O
难度: 困难查看答案及解析
-
下列4种有机物:
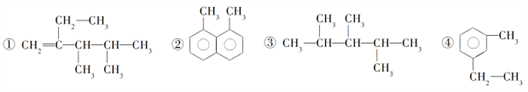
其中一氯取代物的同分异构体数目相同的是 ( )
A. ①和② B. ②和③ C. ①和③ D. ②和④
难度: 困难查看答案及解析
-
部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是

A. V=448 B. 样品中CuO的质量为4.0 g
C. 滤液A中的阳离子为Fe2+、Fe3+、H+ D. 样品中Fe元素的质量为2.14 g
难度: 困难查看答案及解析
-
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)
0.015mol时发生的反应是:
2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3。下列对应关系正确的是
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
A. A B. B C. C D. D
难度: 困难查看答案及解析