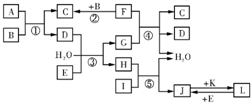
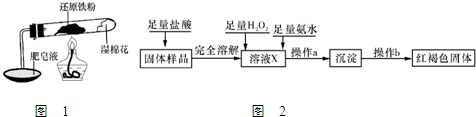
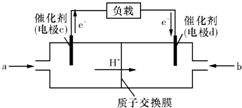
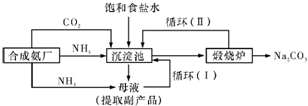
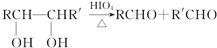
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3; ②还原性:Cl->As; ③每生成1molAs,反应中转移电子的物质的量为3mol; ④M为OH-;⑤SnCl62-是氧化产物.
A.①③⑤
B.①②④⑤
C.①②③④
D.只有①③难度: 中等查看答案及解析
-
X、Y、Z三种元素,已知X+和Y-两种离子具有相同的电子层结构,Z元素原子核内质子数比Y元素原子核内质子数少9个,Y-被氧化可生成YZ3-离子.下列说法正确的是( )
A.离子半径X+>Y-
B.X、Y、Z均属于短周期元素
C.X、Y、Z三种元素组成的物质至少有三种
D.Y属于第VA族元素难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.Na2O2的电子式:
B.甲烷分子的球棍模型:
C.葡萄糖的分子式:CH2O
D.对-硝基甲苯的结构简式:难度: 中等查看答案及解析
-
2011年3月3日晚联合国教科文组织在其巴黎总部举行世界杰出女科学家奖颁奖仪式.香港大学无机化学教授任咏华,她因在发光材料和太阳能创新技术方面取得突出成就而获奖.她主要研究无机发光材料,“魔棒”是一种有机发光材料,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如下.下列有关说法正确的是( )
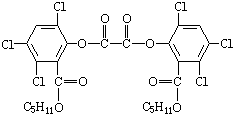
A.1mol草酸二酯与氢气完全反应,需要10molH2
B.草酸二酯属于高分子化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4molNaOH
D.草酸二酯属于芳香族化合物难度: 中等查看答案及解析
-
已知H2(g)+I2(g)⇌2HI(g)△H<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2mol,乙中加入HI 0.4mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度
B.甲降低温度,乙不变
C.甲中加人0.2molHe,乙不改变
D.甲增加0.2molH2,乙增加0.2molI2难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+═2H2O+I2
B.NH4HCO3溶液与过量KOH浓溶液共热NH4++OH-NH3↑+H2O
C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O
D.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O难度: 中等查看答案及解析
-
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol•L-1的Na2CO3溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3)
B.pH=11的Na2CO3溶液中:c(Na+)-c(CO32-)+c(HCO3-)═10-3-10-12
C.浓度分别为0.1mol•L-1和0.01mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者大于后者的10倍
D.0.1mol•L-1的NH4Cl溶液与0.1mol•L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)═c(Na+)>c(OH-)>c(NH4+)>c(H+)难度: 中等查看答案及解析