-
下列生活中常见的现象中,其反应原理不涉及氧化还原反应的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A. 二氧化碳的电子式:
B. 氯化氢的电子式:
C. CH4分子的比例模型:

D. 水的电离方程式:H2O=H++OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙醇的沸点低于丙烷
B. 油脂和蛋白质都是高分子化合物
C. CH2=C(CH3)2的名称是2-甲基-2-丙烯
D. 对二甲苯的核磁共振氢谱有2个吸收峰
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A. 酸性:HCl>HF B. 金属性:Na>Mg
C. 碱性:KOH>NaOH D. 热稳定性:HCl>HBr
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. 向AlCl3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 向稀NaHCO3中加入过量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
C. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
D. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
难度: 中等查看答案及解析
-
室温下,关于1.0 mL 0.1mol/L氨水,下列判断正确的是
A. c(OH-)=c(NH4+) B. 与1.0mL 0.1mol/L盐酸混合后,溶液呈中性
C. 溶液的pH小于13 D. 加入少量NH4Cl固体,c(OH-)不变
难度: 中等查看答案及解析
-
化学反应中,反应物用量或浓度可能对生成物产生影响。下列反应的生成物不受上述因素影响的是
A. 铜与硝酸反应 B. 氢气与氧气反应
C. 硝酸银溶液与稀氨水反应 D. 氯化铝与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是
A. 盐酸与碳酸钙反应生成二氧化碳
B. 镁条与氯化铵溶液反应生成氢气
C. 硝酸银溶液与盐酸反应生成氯化银
D. 硫酸铝溶液和小苏打溶液反应生成二氧化碳
难度: 困难查看答案及解析
-
苯丙炔酸(
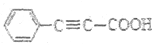 )广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
)广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是A. 分子式为C9H7O2
B. 与丙炔酸(
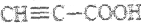 )互为同系物
)互为同系物C. 是高分子化合物
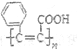 的单体
的单体D. 1mol苯丙炔酸最多可与5mol氢气发生反应,可以发生缩聚反应
难度: 中等查看答案及解析
-
工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2。
2H2(g)+ CO(g)==CH3OH(g) △H=-91.8kJ/mol
2CH3OH(g)==CH3OCH3 (g)+H2O(g) △H=-23.5 kJ/mol
CO(g)+ H2O(g)==CO2(g)+H2(g) △H=-41.3 kJ/mol
下列说法不正确的是
A. CH3OH和乙醇均可发生消去反应
B. CH3OCH3中只含有极性共价键
C. 二甲醚与乙醇互为同分异构体
D. 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)===CH3OCH3 (g)+ CO2(g) △H=-248.4kJ/mol
难度: 中等查看答案及解析
-
铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是
A. 放电时PbO2发生氧化反应
B. 放电时的负极反应式为Pb+SO42--2e-=PbSO4
C. 充电时电解质溶液的质量减少
D. 充电时的阴极反应式为PbSO4+2H2O-2e-==PbO2+SO42-+4H+
难度: 中等查看答案及解析
-
LiOH是制取锂和锂的化合物的原料,用电解法制备LiOH的工作原理如下图所示:
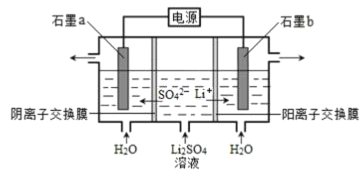
下列叙述不正确的是
A. b极附近溶液的pH减小
B. a极发生的反应为2H2O-4e-===O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1mol电子时,可得到1mol LiOH
难度: 中等查看答案及解析
-
已知A(g)+B(g)
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)
A(g)+B(g)的平衡常数为2.5
难度: 中等查看答案及解析
-
25℃时,pH=3的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是
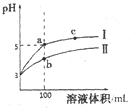
A. 曲线I代表盐酸的稀释过程
B. a溶液的导电性比b溶液的导电性强
C. b溶液中和氢氧化钠的能力强于a溶液
D. 将a、b两溶液加热至30℃,
变小
难度: 困难查看答案及解析
-
下列图示的实验设计能实现相应实验目的的是
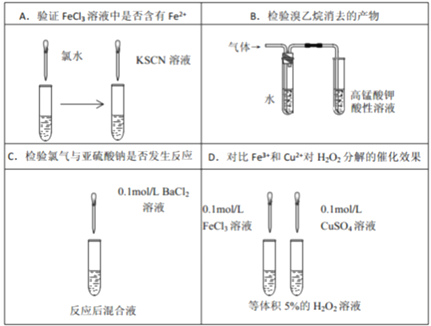
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
某同学设计完成了以下两个实验:
①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。
下列说法不正确的是
A.实验①生成HIO3时发生的反应为:I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
B.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液
C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2 > Br2 > I2
D.由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3 > Cl2 > HIO3
难度: 困难查看答案及解析
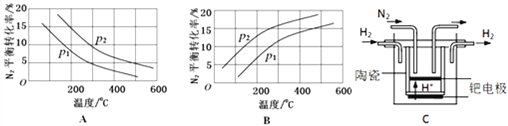
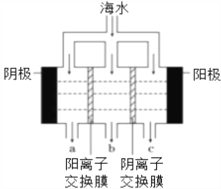
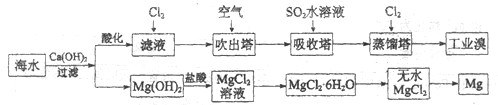
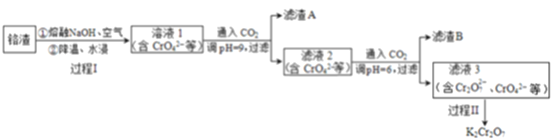
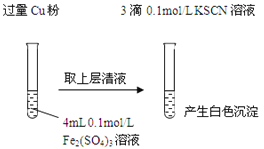


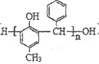 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。