-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LSO3所含的氧原子数为1.5NA
B.常温常压下,7.8gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
C.电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA
D.500ml 1mol/L醋酸溶液中含氧原子数为NA
难度: 困难查看答案及解析
-
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.次氯酸的结构式:H—Cl—O
C.NH4Cl的电子式:
D.硫原子的结构示意图:
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol•L-1 AlCl3溶液中:H+、Na+、Cl-、SO42-
B.含有0.1mol•L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3-
C.使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42-
D.由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl-
难度: 困难查看答案及解析
-
下列有关物质性质应用的说法正确的是( )
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下,二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可制造高温耐火材料,如制耐火管、坩埚等
难度: 中等查看答案及解析
-
下列陈述I、II均正确并且有因果关系的是( )
选项
陈述I
陈述II
A
Fe2O3是红棕色粉末
Fe2O3常做红色涂料
B
SiO2是两性氧化物
SiO2可和HF反应
C
Al2O3难溶于水
Al2O3可用作耐火材料
D
SO2有漂白性
SO2可使溴水褪色
难度: 简单查看答案及解析
-
向100mL 0.1mol/L AlCl3 溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
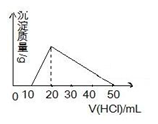
A.0.25mol/L B.0.5 mol/L C.2mol/L D.1mol/L
难度: 困难查看答案及解析
-
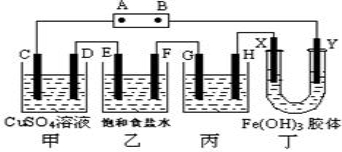
下列关于卤素的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.氧化性Cl2>Br2>I2还原性Cl->Br->I-
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.氯水具有酸性,能使紫色石蕊试剂先变红后退色,也可用pH试纸测量其pH值。
难度: 中等查看答案及解析
-
有一瓶Na2SO3溶液,可能部分被氧化,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入足量稀HCl,充分振荡后仍有白色沉淀,对此实验下列结论正确的是( )
A.加HCl后的不溶沉淀一定为BaSO4
B.此溶液中Na2SO3已部分氧化
C.加入Ba(NO3)2溶液生成的沉淀一定含BaSO4
D.此样品未被氧化
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.因为Na2CO3+SiO2
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
难度: 中等查看答案及解析
-
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 = N2↑ + 6NH3↑ + 3SO2↑ + SO3↑ + 7H2O,将反应后的混合气体先通过浓硫酸,再通入足量的BaCl2溶液,结果为( )
A.产生BaSO3沉淀 B.产生BaSO4沉淀
C.产生BaSO4和BaSO3沉淀 D.无沉淀产生
难度: 中等查看答案及解析
-
下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸 B.将HCl通入NaAlO2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液 D.加热溶有SO2的品红溶液
难度: 简单查看答案及解析
-
下列物质的检验,其结论一定正确的是( )
A.向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42—
B.取少量久置的Na2SO3样品于试管中加水溶解,再加足量盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化
C.向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32— 或SO32—
D.将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为24.X的原子半径比Y大,Y与Z同主族,Y原子的最外层电子数是电子层数的3倍,下列说法正确的是( )
A. X的气态氢化物可与其最高价含氧酸反应生成离子化合物
B. Y元素形成的单核阴离子还原性强于X元素形成的单核阴离子还原性
C. Z元素的简单气态氢化物的沸点比Y的氢化物沸点高
D. W元素氧化物对应水化物的酸性一定强于Z元素氧化物对应水化物的酸性
难度: 中等查看答案及解析
-
根据下表信息,判断以下叙述正确的是部分短周期元素的原子半径及主要化合价( )
元素代号
G
L
M
Q
R
T
原子半径/nm
0.186
0.160
0.143
0.104[
0.075
0.066
主要化合价
+1
+2
+3
+6、﹣2
+5、﹣3
﹣2
A.单质的还原性:G<L<M B.非金属性:T<Q
C.气态氢化物的稳定性:R>T D.L2+与T2﹣的核外电子数相等
难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s);△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s);△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( )
A.+519.4kJ·mol-1 B.-259.7kJ·mol-1 C.+259.7 kJ·mol-1 D.-519.4kJ·mol-1
难度: 简单查看答案及解析
-
下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量
C.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H=akJ/mol,2C(s)+O2(g)=2CO(g) △H=bkJ/mol,则b>a
难度: 中等查看答案及解析
-
在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热为( )
A.-191 kJ/mol B.-488.3 kJ/mol C.+488.3 kJ/mol D.+191 kJ/mol
难度: 中等查看答案及解析
-
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是( )

A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJ•mol﹣1
B.石墨的稳定性强于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
难度: 简单查看答案及解析
-
在下列各溶液中通入足量CO2气体,最终有浑浊产生的是①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液 ⑥NaAlO2溶液
A.全部 B.除①④外 C.除①②③④外 D.除②③④外
难度: 简单查看答案及解析
-
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2 + 4Fe3+ ═ Cu2+ + 5Fe2+ + 2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol[
D.反应中转移电子的物质的量为xmol
难度: 中等查看答案及解析
-
下列有关物质分类或归纳的说法中,正确的是( )
A.SO2、NO2和CO2都是污染性气体
B.熟石灰、铝热剂、盐酸都是混合物
C.煤的干馏、海水中提取碘的过程都包括化学变化
D.A12O3、Cl2、CuSO4在熔融状态或溶于水时均能导电,都属电解质
难度: 简单查看答案及解析