-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液、胶体
D.工业上电解熔融的MgCl2,可制得金属镁
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A.1.0 L 1.0 mo1·L-1的NaAlO2 水溶液中含有的氧原子数为2NA
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.过氧化钠与水反应时,生成0.1mol 氧气转移的电子数为0.2NA
D.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为 CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则消耗氧气的体积2.24L
C.电池反应的化学方程式为:CH3CHO+O2=CH3COOH+H2O
D.正极上发生的反应是:O+4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
向硝酸钡溶液逐渐通入二氧化硫气体,可能发生的离子方程式如下,其中错误的是
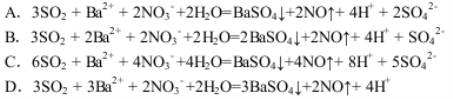
难度: 困难查看答案及解析
-
在密闭容器中进行反应:CH4(g)+H2O(g)
CO(g)+3H2(g)ΔH > 0 , 测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
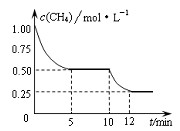
A.10 min时,改变的外界条件可能是升高温度
B.0~5 min内,v(H2)=0.1 mol/(L·min)
C.恒温下,缩小容器体积,平衡后c(H2)减小
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
难度: 困难查看答案及解析
-
关于下列四个图像的说法正确的是

A.已知图①是体系
 中的
中的温度T的平衡图像。A点与B点相比,A点的c(Fe3+) 大
B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系。则反应中镁和铝的反应速率之比为2∶3
C.图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:
D.图④表示分离CCl4萃取碘水后已分层的有机层和水层
难度: 困难查看答案及解析
-
PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是
A.1:2:1混合的PbO2、Pb3O4、PbO
B.1:3:2混合的PbO2、Pb3O4、PbO
C.1:1:1混合的PbO2、Pb3O4、PbO
D.2:1:1混合的PbO2、Pb3O4、PbO
难度: 困难查看答案及解析
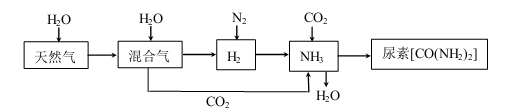


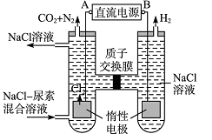
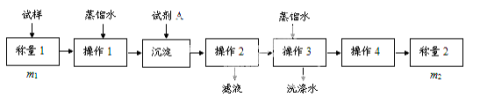
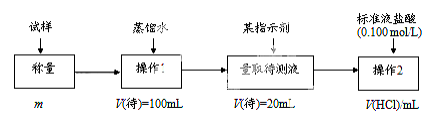
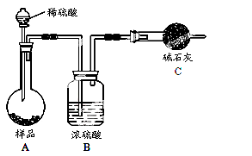
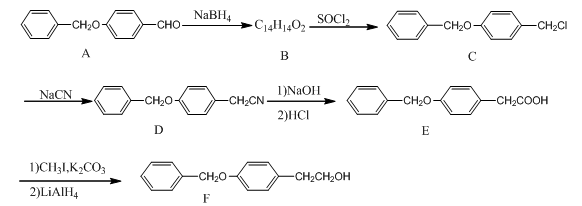
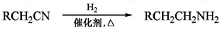 ,请写出以
,请写出以