-
分子式为C4H10O的醇与分子式为C8H8O2且含苯环的羧酸在一定条件下反应生成酯的种类有(不考虑立体异构)
A. 4种 B. 8种 C. 12种 D. 16种
难度: 中等查看答案及解析
-
下列做法不正确的是
A. 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱
B. 金属Mg失火时不能用泡沫灭火器扑灭
C. 土壤胶粒带负电荷,有利于铵态氮肥的吸收
D. 水玻璃可用于生产黏合剂和防火剂
难度: 中等查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A. 原子半径:C>D>A>B
B. C和E的单质可通过电解饱和的CE水溶液获得
C. C与B形成的两种化合物中化学键类型完全相同
D. A、D、E的最高价氧化物对应水化物的酸性逐渐增强
难度: 困难查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
用铂丝蘸取溶液X进行焰色反应实验
火焰呈黄色
溶液X一定是钠盐溶液
B
将Cl2通入石蕊试液中
溶液先变红后褪色
Cl2具有漂白性
C
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
AlO2-与HCO3-发生了双水解反应
D
向FeBr2溶液中加入少量氯水,再加 CCl4振荡
CCl4层无色
Fe2+的还原性强于
Br-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
薄荷醇的结构简式如下图,下列说法正确的是
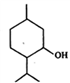
A. 薄荷醇分子中至少有12个碳原子共平面
B. 薄荷醇分子式为C10H20O,它是环戊醇的同系物
C. 1mol薄荷醇与足量Na反应生成22.4LH2
D. 在一定条件下,薄荷醇能发生取代、中和、氧化等反应
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/L的NaOH和CH3COONa混合溶液中滴加0.1mol/L的盐酸,所得滴定曲线如图所示。下列说法正确的是
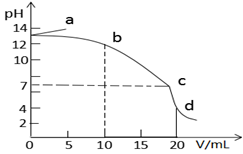
A. a点溶液加水稀释,
 逐渐增大
逐渐增大B. b→c段发生反应的离子方程式是:CH3COO- + H+ = CH3COOH
C. c点时水的电离程度最大
D. d点溶液中c(Na+)=c(Cl-)>c(CH3COOH)>c(CH3COO-)>c(H+)
难度: 困难查看答案及解析
-
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。电池工作时的总反应为:LiFePO4+6C
Li1-xFePO4+LixC6,则下列说法正确的是
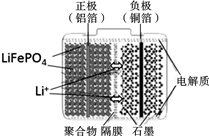
A. 图中聚合物隔膜是阴离子交换膜;
B. 充电时,Li+ 迁移方向是“由右向左”
C. 放电时,正极的电极反应式为LiFePO4—xe- = Li1-xFePO4 + xLi+
D. 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80%
难度: 困难查看答案及解析
-
以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变 b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变 d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H<0 在一定条件下,某反应过程中部分数据如下表:
反应条件
反应时间
CO2(mol)
H2(mol)
CH3OH(mol)
H2O(mol)
恒温
恒容
(T1℃、
2L)
0min
2
6
0
0
10min
4.5
20min
1
30min
1
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的 转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T2℃,此时H2的物质的量为3.2mol,则T1_________T2(填“>”、“<”或“=”),理由是_________。在其他条件不变的情况下,若30min时向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡_________移动(填“正向”、“逆向”或“不”).
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
难度: 中等查看答案及解析

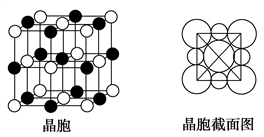
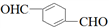 )的合成路线如下:
)的合成路线如下: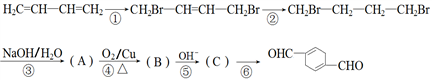
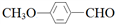 合成
合成 。 (其他原料自选,用反应流程图表示,并注明必要的反应条件)。
。 (其他原料自选,用反应流程图表示,并注明必要的反应条件)。