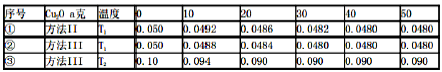
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.9g甲基(-CH3)所含有的电子数是10NA个
B.22.4L乙烷中含有的共价键数为7NA个
C.常温下,14g乙烯和丙烯的混合物中总原子数为3NA
D.4.2gC3H6中含有的碳碳双键数一定为0.1NA
难度: 中等查看答案及解析
-
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水。向一定量的W的最高价价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
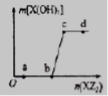
A.d点对应的溶液中:K+、NH4+、CO32-、I-
B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
C.b点对应的溶液中:Na+、S2-、SO42-、Cl-
D.a点对应的溶液中:Na+、K+、SO42-、HCO3-
难度: 困难查看答案及解析
-
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的量如下表。
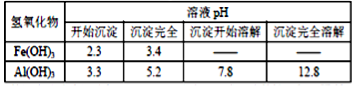
向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情况如下图所示.以下推断错误的是
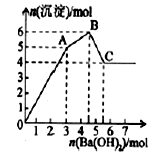
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
难度: 极难查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀.沉淀质量为39.2g.下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.4mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为1mol
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。其中X与W处于同一主族,Z元素的原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等。五种元素原子最外层电子数之和为21。下列说法正确的是
A. Y的简单离子半径小于Z的简单离子半径
B. Z的最高价价化物对应水化物分别与X、Y的最高价价化物对应水化物反应生成lmol水时所放出的热量相同
C. Y的简单气态氢化物在一定条件下可被Q单质氧化
D. Q可分别与X、Y、Z、W形成化学健类型相同的化合物
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学健断裂时吸收的能量与化学健形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是
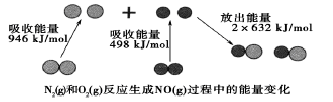
A.1molN2(g)和1molO2(g)反应放出的能量为180kJ
B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
C.在1L的容器中发生反应.10min内N2减少了1mol,因此10min内的平均反应速率为v(NO)=0.1mol/(L·min)
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是
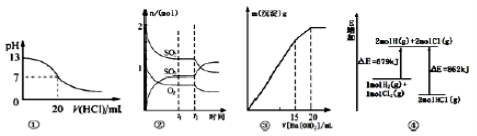
A.图①表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g)+O2(g)
2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矶溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(0H)2溶液体积的关系,在加入20mL溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183kJ/mol
难度: 困难查看答案及解析
-
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2(g)+O2(g)
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
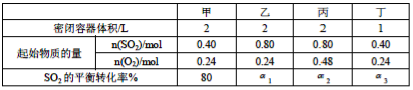
A.甲中反应的平衡常数小于乙B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:a1>a2=a3D.容器中S03的物质的量浓度:丙=丁<甲
难度: 困难查看答案及解析
-
已知X、M都是中学教材中的常见元素,(甲)XO3n-+Xn-+H+→X(单质)+H2O(未配平):(乙Mm++mOH-=M(OH)m↓。下列对两个离子反应通式的推断中。正确的是
①若n=1,则XO3n-中X元素为+5价,X位于周期表第VA族
②若n=2,则X最高价价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③B.②③C.①②D.④⑤
难度: 困难查看答案及解析
-
40℃时.在氮-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是
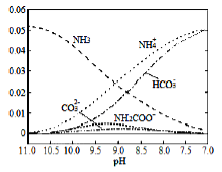
A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)。
C.随着CO2的通入,
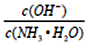 不断增大
不断增大D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
难度: 困难查看答案及解析
-
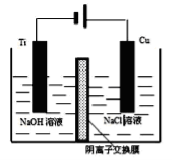
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后.向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准伏况下)O2,此时丙池中理论上最多产生1.45g固体
难度: 困难查看答案及解析
-
八硝基立方烷是一种新型高能炸药,该炸药的结构式如下图所示,由立方烷的氢全部被硝基取代制得,它与三硝基甲苯类似,对震动的敏感度比较低.据信是迄今最烈性的非核爆炸品。关于这种炸药,下列说法错误的是
A.分子式为C8(NO2)8,同种元素的原子在分子中是毫无区别的
B.它爆炸时的反应方程式是:C8(NO2)8=8C02+4N2,气体体积膨胀将引起激烈爆炸
C.八硝基立方烷是一种高能化合物,分解时将吸收大量能量
D.八硝基立方烷爆炸后会产生大量烟雾
难度: 中等查看答案及解析
-
某烃有两种或两种以上的同分异构体.其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是
①分子中具有7个碳原子的芳香经;②分子中具有4个碳原子的烷经;③分子中具有12个氢原子的烷烃;④分子中具有8个碳原子的烷烃
A.③④
B.①②
C.②③
D.②④
难度: 中等查看答案及解析
-
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na,而与金属钠反应时生成C5H8O3Na2;则与该有机物具有相同官能团的同分异构体的种类(不考虑立体异构)有
A.10种
B.11种
C.12种
D.13种
难度: 困难查看答案及解析
-
贝诺酯是由阿司匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下,

下列叙述错误的是
A.FeCl3溶液可区别阿司匹林和扑热息痛
B.1mol阿司匹林最多可消耗3molNaOH
C.常温下贝诺酯在水中的溶解度大干扑热息痛的
D.扑热息痛发生类似酯水解反应的产物之一分子式为C6H7NO2
难度: 中等查看答案及解析
-
利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)=CH3OH(g)。在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应.测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。下列说法正确的是
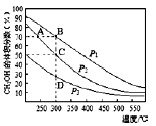
A.该反应的△H<O,且p1<p2<p3
B.在C点时,H2转化率为75%
C.反应速率:v逆(状态A)>v逆(状态B)
D.在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,
达平衡时CH3OH的体积分数增大
难度: 极难查看答案及解析
-
下列图示与对应的叙述相符的是
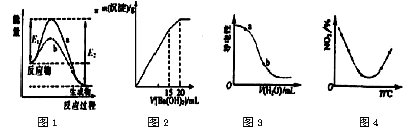
A.图l表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化.且加入催化剂改变反应的焓变
B.图2表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入
20mLBa(OH)2溶液时铝离子恰好沉淀完全
C.图3表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3C00H溶液的pH:a>b
D.图4表示等量NO2在容积相同的恒容密闭容器中.不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0
难度: 困难查看答案及解析
-
胡妥油(D)用作香料的原料,它可由A合成得到:
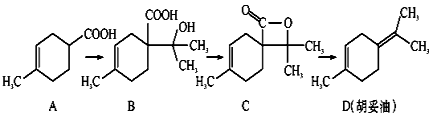
A.从B到C的反应是消去反应
B.D分子中所有碳原子一定共面
C.等物质的量的B分别与足量的Na、NaHCO3反应,产生的气体的物质的量前者大于后者
D.若A是由2-甲基-1,3-丁二烯和内烯酸(CH2=CHCOOH)加热得到的,则该反应的类型属于加成反应
难度: 困难查看答案及解析
-
硬脂酸甘油酯经皂化反应后,得到硬脂酸钠和甘油。欲分离出硬脂酸钠.应采用的方法是:①用滤纸过滤②用分液漏斗分液③加热蒸发④加入热的饱和食盐水
A.④③
B.④②
C.①③
D.④①
难度: 简单查看答案及解析
-
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
则下列说法正确
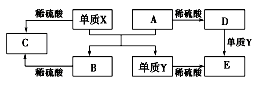
A.单质X与A反应的化学方程式:Al2O3+2Fe
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应.又能与碱反应,所以两者均是两性化合物
难度: 中等查看答案及解析


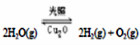 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示: