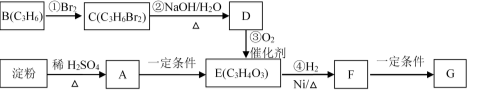
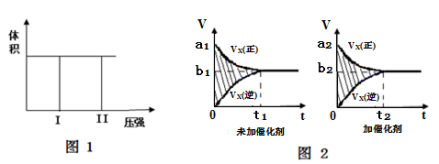
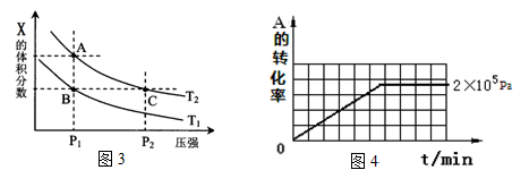
-
下列说法不正确的是
A.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
B.汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率
C.2014年诺贝尔化学奖授予美国科学家埃里克·贝齐格、威廉·莫纳和德国科学家斯特凡·黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,利用此类显微镜可以观察病毒以及活细胞内蛋白质等大分子
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油,实现厨余废物合理利用
难度: 简单查看答案及解析
-
下列说法正确的是
A.氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-
[CoCl4]2-(蓝色)+6H2O
△H =akJ·mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0
B.用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小
C.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用
D.右图表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2

难度: 中等查看答案及解析
-
短周期元素X、Y、Z、R和W在元素周期表的位置如下表所示,其中W元素族序数等于周期序数的2倍。则下列说法正确的是

A.原子半径从小到大:X<Y<R<W
B.Z、W元素与X均可以形成AB2型化合物
C.X有多种同素异形体,而Z不存在同素异形体
D.Z的氢化物的稳定性大于W的氢化物,是因为Z的氢化物分子间存在氢键
难度: 中等查看答案及解析
-
下列说法或表述中正确的是
A.烷烃
的系统命名为2-甲基-2-乙基丙烷
B.由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯
C.右图所示的有机物分子式为C14H12O2,能发生银镜反应
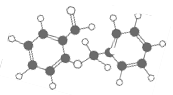
D.在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH
难度: 中等查看答案及解析
-
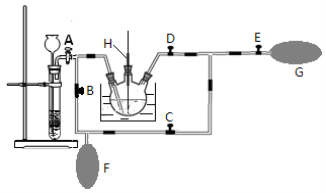
某同学按如下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析正确的是

A.溶液中c(A2+)减小
B.B的电极反应:B-2e- =B2+
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,一段时间以后沉淀逐渐溶解
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系不正确的是
A.若将适量CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+ c(HCO3ˉ)= 0.1 mol·L-1
B.在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02)
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后
难度: 困难查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1 mol·L-1。某同学进行了如下实验,下列说法正确的是

A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
难度: 困难查看答案及解析