-
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在 B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与任何酸反应 D.气态氢化物比甲烷稳定
难度: 中等查看答案及解析
-
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
A.酸性 B.脱水性 C.强氧化性 D.吸水性
难度: 简单查看答案及解析
-
在下列溶液中通入SO2一定不会产生沉淀的是
A.Ba(OH)2 B.Ba(NO3)2 C.Na2S D.BaCl2
难度: 中等查看答案及解析
-
120 mL含有0.20 mol碳酸钠溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液仍呈红色
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合:
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑
难度: 中等查看答案及解析
-
下列实验现象的描述错误的是
A.氢气在氯气中燃烧生成绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
难度: 中等查看答案及解析
-
下列物质能通过化合反应直接制得的是
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C.只有①③④ D.全部
难度: 中等查看答案及解析
-
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A、N4是N2的同素异形体
B、N4是N2的同分异构体
C、相同质量的N4和N2所含原子个数比为1:2
D、N4的摩尔质量是56g
难度: 中等查看答案及解析
-
含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
难度: 中等查看答案及解析
-
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80 MPa下合成出金刚石,具有深远意义。下列说法不正确的是
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法错误的是:
A.1mol C2H6分子中共含7NA个共价键
B.25℃时,1mL纯水中含水10-10NA个OH-离子
C.当NO2溶于水产生1molNO时,反应转移的电子数为2NA。
D.标准状况下,22.4L三氧化硫所含的氧原子数等于3NA
难度: 中等查看答案及解析
-
在室温时,下列各组中的物质分别与足量NaOH溶液反应,生成盐的种类最多的是
A.Cl2、Al(NO3)3、SO2、SiO2 B.CO、Al、NaHCO3、N2O5
C.SiO2、NH4HCO3、SO3、CO2 D.CaO、CO2、Cl2、NH4Al(SO4)2
难度: 中等查看答案及解析
-
下列变化能够实现的是
①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成
③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体
A.①③ B.②④ C.①②④ D.①②③④
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 困难查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
下列叙述正确的是
A.
和
互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
难度: 中等查看答案及解析
-
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是

①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①② B.②④ C.③④ D.②③
难度: 中等查看答案及解析
-
能正确表示下列反应的化学方程式是
A.黄铁矿煅烧:2FeS2+5O2
2FeO+4SO2
B.石英与石灰石共熔:SiO2+CaO
CaSiO3
C.氨的催化氧化:4NH3+5O2
4NO+6H2O
D.氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl3+CaClO2+2H2O
难度: 中等查看答案及解析
-
在标准状况下,向100 mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为

A.0.5 mol/L B.0.05 mol/L C.1 mol/L D.0.1 mol/L
难度: 中等查看答案及解析
-
柳州的龙江河铬污染事故再一次令人触目惊心,环境保护刻不容缓。下列关于铬的一种原子
说法正确的是
A.
与
互为同素异形体
B.
含有24个中子
C.
与
互为同位素,物理性质、化学性质均相同
D.
中子数比电子数多4个
难度: 中等查看答案及解析
-
下列表示物质结构的化学用语正确的是
A.含7个中子的碳原子符号:12C
B.NaCl的电子式:
C.氯原子的结构示意图:
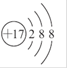
D.CSO的电子式:
难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图3中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B组成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是
A.化合物YZ3极易溶解于水
B.Z与M可以形成含有非极性键的化合物
C.12 g14X中含有中子的物质的量为8 mol
D.由上述四种元素组成的离子化合物受热易分解
难度: 困难查看答案及解析
-
已知下列热化学方程式,则③中的Q3值为
Zn(s)+
O2(g)= ZnO (s) △H= - Q1 kJ• mol-1 ①
Hg(l) +
O2(g)= HgO (s) △H= -Q2 kJ• mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ• mol-1 ③
A.Q2 -Q1 B.Q1 +Q2 C.Q1- Q2 D.-Q1- Q2
难度: 中等查看答案及解析
