-
化学与人类的生活息息相关,下列有关说法正确的是
A. 食品添加剂对于改善食品外观、防止食品腐败具有重要作用
B. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
C. 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物
D. 泰国银饰和土耳其彩瓷是“一带一路” 沿线国家特色产品,其主要成分均属于金属材料
难度: 简单查看答案及解析
-
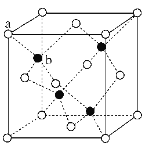
下列有关化学用语表示正确的是
A. 镁离子的结构示意图:
 B. 氨基的电子式:
B. 氨基的电子式:C. 乙醇的结构简式:C2H6O D. 中子数为79、质子数为55的铯(Cs)原子:
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L正戊烷中含有的碳原子数为0.5 NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1mol CO与0.1mol H2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2=Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
难度: 中等查看答案及解析
-
(题文)下列说法正确的是
A. 按系统命名法
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 聚乙烯( PE)和聚氯乙烯( PVC)的单体都是不饱和烃,这些单体均能使溴水褪色
难度: 中等查看答案及解析
-
下列除杂方法正确的是
选项
物质
杂质
试剂
主要操作
A
苯
苯酚
浓溴水
过滤
B
AlCl3溶液
NaAlO2
盐酸
___
C
SO2
乙烯
酸性高锰酸钾
洗气
D
NaHCO3溶液
Na2CO3
CO2
_____
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验方案中不能达到相应实验目的的是
选项
A
B
C
D
方案

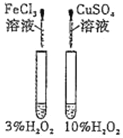
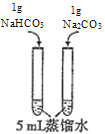
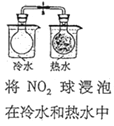
目的
探究浓度对化学反应速率的影响
探究催化剂对H2O2分解速率的影响
室温下比较NaHCO3和Na2CO3的溶解度
探究温度对化学平衡的影响
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
难度: 中等查看答案及解析
-
含有下列各组离子的溶液中,后各离子仍能大量存在的是
选项
溶液中的离子
通入(或加入)过量的某种物质
A
H+、Ba2+、Fe3+、NO3-
通入SO2气体
B
AlO2-、Na+、Br-、SO42-
通入CO2气体
C
HCO3-、Na+、I-、HS-
加入AlCl3溶液
D
Ca2+、Cl-、K+、H+
通入CO2气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有关下列四个常用电化学装置的叙述中,正确的是
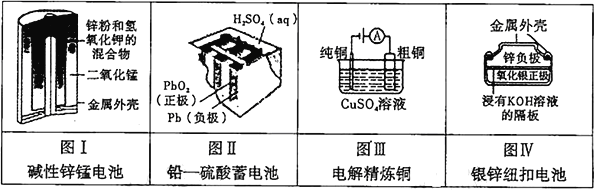
A. 图Ⅰ所示电池中,MnO2是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池工作过程中,电子由Zn极流向Ag2O极
难度: 中等查看答案及解析
-
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。

下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
难度: 中等查看答案及解析
-
一定条件下,下列各组物质能一步实现图中所示转化关系的是

选项
X
Y
Z
W
A
Al
Al2O3
NaAlO2
Al(OH)3
B
Fe3O4
Fe
FeCl2
FeCl3
C
H2SO4
SO2
S
SO3
D
CH3CH2Br
CH2=CH2
C2H5OH
CH2BrCH2Br
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,向10 mL 0.1 mol·L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列叙述错误的是

A. C点溶液中含有NaHA和Na2A
B. NaHA溶液中水的电离程度比Na2A溶液中小
C. B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)]
D. D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+)
难度: 中等查看答案及解析
-
已知在一定条件下,反应 X(g)+3Y(g
2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是

A. 图中a、b两点对应的平衡常数相等
B. 上述反应在达到平衡后,缩小体积,Y的转化率提高
C. 升高温度,正、逆反应速率增大,平衡向正反应方向移动
D. 将2.0molX、6.0molY,置于密闭容器中发生反应,放出的热量为2akJ
难度: 困难查看答案及解析
-
生产环氧乙烷(
)的反应为:2CH2=CH2(g)+O2(g)
2
(g) ΔH=-106kJ/mol,其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→
+ AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ/mol
B. 该反应的原子利用率为100%
C. AgO2也是该反应的催化剂
D. 增大乙烯的浓度只能显著提高环氧乙烷的生成速率
难度: 中等查看答案及解析
-
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
①
②
③
④
pH
12
12
2
2
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
难度: 困难查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
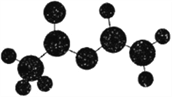
A. 该化合物的名称为乙酸乙酯
B. 1mol该化合物与2 mol Br2发生加成反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
难度: 中等查看答案及解析
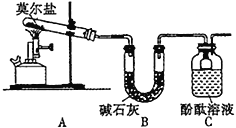
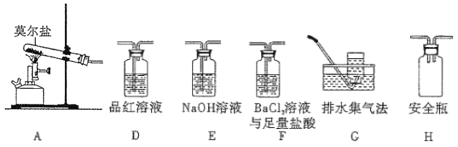
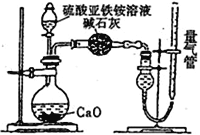
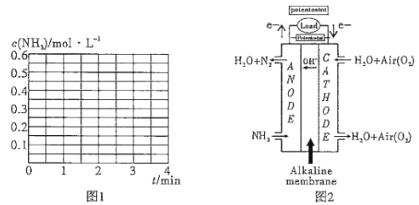

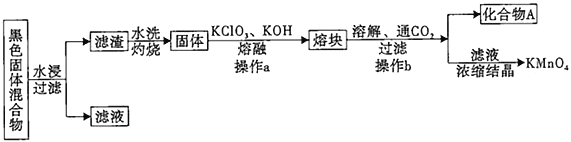
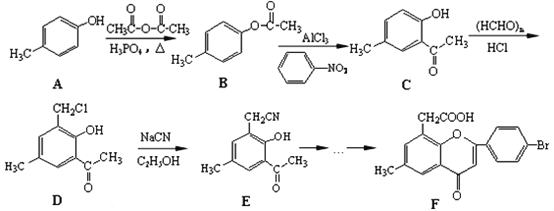
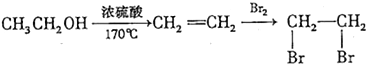 _______。
_______。