-
下列说法正确的是( )
A.阴极射线、
-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
B.纤维素、PLA、纤维二糖、甲壳素、硝化纤维等都是高分子化合物
C.高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一
D.硫、白磷、臭氧、碳-60、氩、水等物质固态时都是分子晶体,分子内都存在共价键
难度: 简单查看答案及解析
-
下列有关物质的性质或应用的说法不正确的是( )
A.二氧化硅是生产光纤制品的基本原料 B.水玻璃可用于生产黏合剂和防火剂
C.亚硝酸钠可以用作食品添加剂 D.石油分馏可获得乙烯、丙烯和丁二烯
难度: 简单查看答案及解析
-
(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入BaCl2溶液,产生的沉淀为( )
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
难度: 简单查看答案及解析
-
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是( )
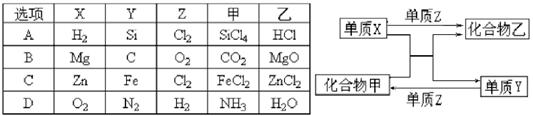
难度: 简单查看答案及解析
-
下列实验装置、试剂选用或操作正确的是( )
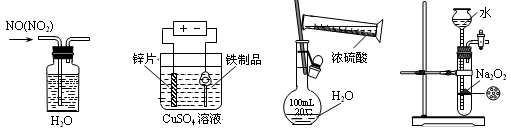
A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
难度: 简单查看答案及解析
-
锌空气燃料电池具有安全、零污染、高能量、大功率、低成本及材料可再生等优点,因而被专家们认为是装备电动汽车等的理想动力电源。锌空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,锌为负极,空气电极为正极。下列说法正确的是( )
A.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
B.以NaOH溶液为电解液时,负极反应为:Zn+4OH--2e-→ZnO2-+2 H2O
C.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+4e-→2O2-
D.电池工作时,电子通过外电路从正极流向负极
难度: 简单查看答案及解析
-
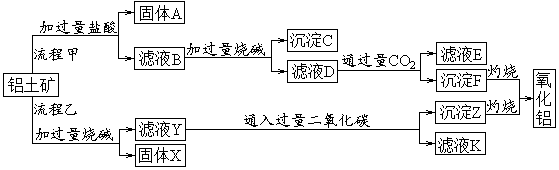
铝元素是金属元素,某同学认为铝也有一定的非金属性。下列描述中,你认为能支持该同学观点的是( )
A.铝片能与盐酸反应生成氢气 B.氢氧化铝能溶于强碱溶液
C.氯化铝溶液显酸性 D.铝能发生铝热反应
难度: 简单查看答案及解析
-
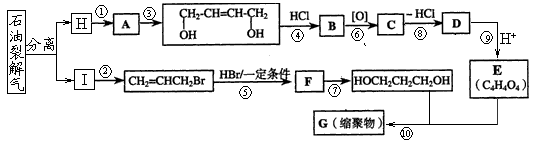
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是 ( )

A.反应①是加成反应 B.只有反应②是加聚反应
C.只有反应⑦是取代反应 D.反应④⑤⑥是取代反应
难度: 简单查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ∙mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g)
2NH3(g) △H=-38.6kJ∙mol-1
C.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH‑+3H2O=2 Al(OH)4-
难度: 简单查看答案及解析
-
研究发现,空气其中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用没有相似之处的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶 B.硫化氢通入浓H2SO4中
C.浓H2SO4、铜混合共热 D.加入少量H2SO4使乙酸乙酯水解
难度: 简单查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1∶8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
难度: 简单查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
物质 选 项
a
b
c
A
Al
AlCl3
Al(OH)3
B
HNO3
NO
NO2
C
Si
SiO2
H2SiO3
D
CH2=CH2
CH3CH2OH
CH3CHO
难度: 简单查看答案及解析
-
在一定条件下,反应CO(g)+2H2(g)
CH3OH(g)在一密闭容器中达到平衡。充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率将( )
A.增大 B.减小 C.不变 D.无法判断
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与反应制取少量氯气: MnO2+2H++2Cl- =Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过少量CO2制Al(OH)3:AlO2+CO2+2 H2O= Al(OH)3↓
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+4H+
难度: 简单查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
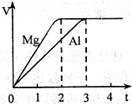
A.物质的量之比为3∶2 B.质量之比为3∶2
C.摩尔质量之比为2∶3 D.反应速率之比为2∶3
难度: 简单查看答案及解析