-
化学与人类生活、工农业生产、科学技术等息息相关,下列说法正确的是( )
A.在涂料中尽量用液态有机物代替水作溶剂以减少环境污染
B.新型无机非金属材料Si3N4、Al2O3可以用于制作高温结构陶瓷制品
C.石油分馏可获得乙烯、丙烯和丁二烯
D.绿色化学的核心是应用化学原理对环境污染进行治理
难度: 中等查看答案及解析
-
《美国化学会志》报道了中国科学家以二氧化碳和钠在一定条件下制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石)。设NA为阿伏加德罗常数的数值,下列有关此反应的叙述中,不正确的是( )
A.1mol C(金刚石)中含有c—c键数目为2NA
B.金刚石与石墨互为同素异形体
C.当有0.4molNa参加反应时,消耗的CO2的体积为6.72L
D.3molCO2参加反应时.转移电子数目为4NA
难度: 中等查看答案及解析
-
如图所示是氢氧燃料电池的基本结构,将电极a、b分别与负载连接后,电池就能正常工作。下列有关该燃料电池工作时的叙述中,不正确的是( )
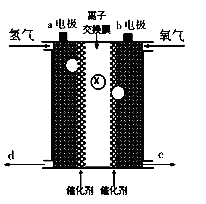
A.a电极一定是负极
B.若X是H+则H+将从a电极通过离子交换膜移向b电极
C.若x是O2-则生成的水将从d口流出
D.溶液中的电流方向是从b流向a
难度: 中等查看答案及解析
-
在给定的条件下的下列溶液中,一定能大量共存的粒子组是(
A.pH=3的溶液:Ca2+、CH3COOH、Br-、Na+
B.水电离的c(H+)=1×10-13mo1·L-1的溶液:Na+、K+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:NH4+、H+、SO42-、I-
难度: 中等查看答案及解析
-
下列各图所示的实验原理、方法、装置、操作或叙述,不正确的是

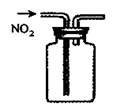
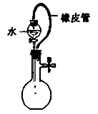
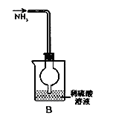
A.称量25 .0g氯化钠固体 B.收集NO2气体 C.检验出此装置漏气 D.吸收NH3不会造成倒吸(尾气处理装置略)
难度: 中等查看答案及解析
-
对于反应N2(g)+3H2(g)
2NH3(g) △H=-92kJ/mol,若只改变下列一个条件,一定能增大正反应速率且使平衡向正反应方向移动的是( )
A.升高温度 B.增大容器体积
C.降低c(NH3) D.将三种物质浓度均增大到原来的2倍
难度: 中等查看答案及解析
-
已知碳酸的电离常数:K1=4 .4×l0-7,K2=4 .7×l0-11。HCO3-的水解常数Kh2=2.27 ×l0-8,CO32-的水解常数Khl=2.12×l0-4。现将0 2mol/L的KHCO3溶液与0.1mol/L的NaOH溶液等体积混合,下列说法正确的是( )
A.酸性
,碱性
B.
C.
D.
难度: 中等查看答案及解析