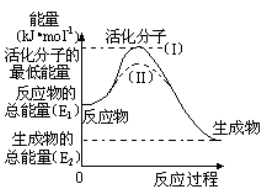
-
把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度。对反应速率有影响的是( )
A. ①② B. ③④ C. ①②③④ D. ①②③
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g) === 2HF(g) △H=-270 kJ· mol-1,下列说法正确的是( )
A.2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量
B.1 mol氢气与1mol氟气反应生成2mol液态氟化氢放出热量小于270 kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
难度: 简单查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ•mol-1、285.8 kJ•mol-1、890.3 kJ•mol-1、2 800 kJ•mol-1,则下列热化学方程式正确的是( )
A. C(s)+
O2(g) ===CO(g) △H=-393.5 kJ•mol-1
B. 2H2(g)+O2(g) ===2H2O(g) △H=+571.6 kJ•mol-1
C. CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-890.3 kJ•mol-1
D.
C6H12O6(s)+3O2(g) ===3CO2(g) +3H2O(l) △H=-1 400 kJ•mol-1
难度: 简单查看答案及解析
-
已知:(1)Zn(s)+
O2(g)===ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+
O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,则Zn(s)+ Ag2O(s) ===ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1 C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
难度: 简单查看答案及解析
-
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是( )
A. X2+2Y2
2XY2 B. 2X2+Y2
2X2Y
C. 3X2+Y2
2X3Y D. X2+3Y2
2XY3
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
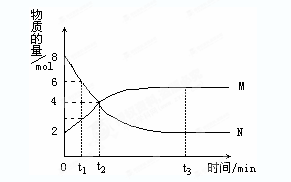
A. 反应的化学方程式为:2M
N B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率 D. t1时,N的浓度是M浓度的2倍
难度: 简单查看答案及解析
-
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是( )
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
难度: 简单查看答案及解析
-
某温度下,反应SO2(g)+
O2(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
2SO2(g) + O2(g)的平衡常数K2的值为( )
A. 2500 B. 100 C. 4×10-4 C D. 2×10-2
难度: 简单查看答案及解析
-
用食用白醋(醋酸浓度约1 mol•L-1)进行下列实验,能证明醋酸为弱电解质的是( )
A. 白醋中滴入石蕊试液呈红色 B. 白醋加入豆浆中有沉淀产生
C. 蛋壳浸泡在白醋中有气体放出 D. pH试纸显示白醋的pH为2~3
难度: 简单查看答案及解析
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
难度: 简单查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A. c(NH4+) = c(SO42-) B. c(NH4+)=2c(SO42-)
C. 2c(NH4+)=c(SO42-) D. c(OH-)+c(SO42-) = c(H+)+c(NH4+)
难度: 简单查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A. HCOOH+H2O
HCOO-+H3O+ B. CO2+H2O
HCO3-+H+
C. CO32-+H2O
HCO3- +OH- D. HS-+H2O
S2-+H3O+
难度: 简单查看答案及解析
-
在含有浓度均为0.01mol•L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是( )
A. AgCl、AgBr、AgI B. AgI、AgBr、AgCl
C. AgBr、AgCl、AgI D. 三种沉淀同时析出
难度: 简单查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
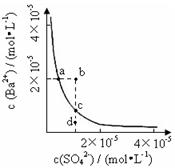
提示:BaSO4(s)
Ba2+(aq)+SO42- (aq)的平衡常数Ksp=c(Ba2+)•c(SO42-),称为溶度积常数。
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
难度: 简单查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
A.⊿H1>⊿H2>⊿H3 B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3 D.⊿H1>⊿H3>⊿H2
难度: 简单查看答案及解析
-
有一处于平衡状态的反应:X(s)+3Y(g)
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
难度: 简单查看答案及解析