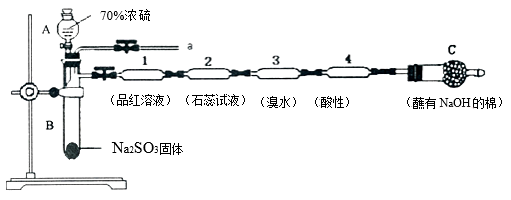
-
从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是
A. Cu + HNO3(浓)→ Cu(NO3)2
B. Cu + HNO3(稀)→ Cu(NO3)2
C. Cu →CuO →Cu(NO3)2
D. Cu + AgNO3 →Cu(NO3)2
难度: 中等查看答案及解析
-
用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是
A. 氯化物 B. 硫酸盐 C. 硝酸盐 D. 碳酸盐
难度: 中等查看答案及解析
-
某固体化合物的化学式NH5,它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )
A. 它与足量的水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
B. NH5中只有极性共价键的共价化合物
C. 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数)
D. NH5中所有原子最外层均为8个电子
难度: 中等查看答案及解析
-
下列实验中,操作和现象均正确且能实现相应实验目的的是
选项
实验目的
操作
现象
A
验证BaSO3难溶于水
将SO2通人Ba(NO3)2溶液中
有白色沉淀生成
B
验证非金属性:Br>I
将溴水滴加到淀粉KI溶液中
溶液变蓝
C
验证SO2的漂白性
将SO2通入酸性KMnO4溶液中
KMnO4溶液褪色
D
验证某化合物一定是钠盐
将该化合物在酒精灯上灼烧
焰色为黄色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是( )
A. 在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性
B. Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物
D. 向碘水中滴加CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘
难度: 中等查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质,由于浓度不同而能发生不同氧化还原反应的是( )
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
A.①③ B.③④ C.①② D.①③④
难度: 简单查看答案及解析
-
化学与生活、科技关系密切。下列说法正确的是
A. 液氨可用作制冷剂是因为其气化时可放出大量的热
B. 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素
C. 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属
D. 久置的漂白粉变质是因为漂白粉与空气中的O2反应
难度: 简单查看答案及解析
-
下列物质的分类合理的是( )
A. 酸性氧化物:CO2、SiO2、SO2、NO2
B. 碱:NaOH、KOH、Ba(OH)2、纯碱
C. 混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体
D. 碱性氧化物:Na2O2、CaO、MgO、Al2O3
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述不正确的是( )
A. 常温常压下,7.8 gNa2O2含有的Na+数为0.2NA
B. 标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA
C. 标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L
D. 50 ℃、1×105Pa下46g NO2与0 ℃、 2×105 Pa下46 g N2O4均含有3NA个原子
难度: 中等查看答案及解析
-
溶液中可能大量存在的一组离子是( )
A. H+、Cl-、PO43-、Na+ B. H+、Fe2+、SO42-、NO
C. K+、H+、NO
、Na+ D. OH-、Br-、SO42-、NH4+
难度: 简单查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是( )
A.分离碘和酒精

B.除去CO2中的HCl

C.实验室制氨气

D.排水法收集NO

难度: 简单查看答案及解析
-
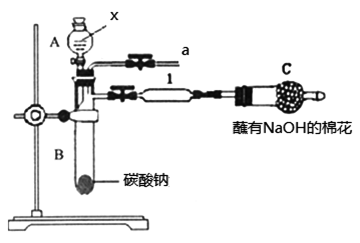
在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
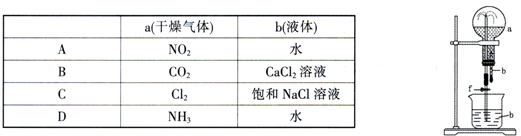
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列反应离子方程式正确的是( )
A. 向NaOH溶液中通入氯气:2OH—+Cl2===Cl—+ClO—+H2O
B. 氨气与盐酸反应:NH3+HCl===NH4++Cl—
C. 碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
D. 将稀硝酸滴在铁片上:Fe+2H+===Fe2++H2↑
难度: 中等查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是( )
A. 非金属性:Cl > Br B. 酸性:H2SO3 > H2CO3
C. 碱性:KOH > NaOH D. 热稳定性:NH3 > PH3
难度: 中等查看答案及解析
-
关于碱金属单质的性质叙述错误的是( )
A. 都能够在空气中剧烈燃烧
B. 都能够与水反应生成碱和H2
C. 都可以保存在煤油中
D. 都是密度比较小、熔点比较低的金属
难度: 简单查看答案及解析
-
对增生性瘢痕早期进行
(锶)干预可取得较好效果。下列说法正确的是( )
A. Sr为于第4周期ⅡA 族
B.
核内中子数与质子数之差为14
C.
与
互为同位素
D.
的核内质子数为38,Sr元素的相对原子质量为90
难度: 简单查看答案及解析
-
下列关于卤族元素(X)及其化合物叙述错误的是( )
A. 单质均有颜色,随原子序数递增颜色加深
B. HX随原子序数递增稳定性逐渐减弱
C. 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H-X-O
D. HX中除HF分子间存在氢键,其余HX分子均不存在氢键
难度: 简单查看答案及解析
-
下列关于原子结构与元素性质的说法正确的是( )
A. 同种元素的原子均有相同的质子数和中子数
B. 全部由非金属元素组成的化合物中只含共价键
C. ⅦA族元素是同周期中非金属性最强的元素
D. 同一主族的元素,原子半径越大,其单质的熔点一定越高
难度: 简单查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如右下图。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C 分别是
A. Be、Na、Al B. B、Mg、Si
C. O、P、Cl D. C、Al、P
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z原子序数依次减小,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且Y的原子半径大于Z。下列叙述正确的是( )
A. 原子半径: W>X>Y
B. X的单质不能与Z的氧化物反应
C. W的单质在Y的单质中燃烧产生淡蓝色火焰
D. X、Y可形成既有离子键又有共价键的离子化合物
难度: 中等查看答案及解析
-
短周期元素X和Y,可组成化合物XY3。当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是( )
A. ①② B. ①②③ C. ①②③⑤ D. ①②④⑤
难度: 困难查看答案及解析