-
化学与社会、生活密切相关,下列说法不正确的是
A.在食品袋中放入盛有CaO和硫酸亚铁的透气小袋,可防止食物受潮、氧化变质
B.MgO、Al2O3的熔点很高,工业上用于制作耐高温材料,也用与冶炼铝和镁
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.利用ClO2对自来水消毒主要是因为ClO2具有强氧化性
难度: 简单查看答案及解析
-
能用如图气体制取装置制取少量气体并能“随开随用、随关随停”的是
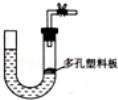
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.过氧化钠和水制取氧气
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.500mL2mol/L葡萄糖溶液中所含分子数为NA
B.0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA
C.电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2NA个电子
D.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Al3+、Cl-、Na+、HCO3-、SO42-
②pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32-
③加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
④使pH试纸呈红色的溶液中:Fe3+、MnO4-、Na+、SO42-
⑤酸性溶液中:Fe2+、Al3+、NO3-、I-
A.①②④ B.①⑤ C.②③④ D.①②③
难度: 中等查看答案及解析
-
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g.。
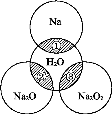
下列说法正确的是
A.Na2O2晶体中阴阳离子数目之比为1∶1
B.反应③最多能产生0.05 mol O2
C.反应①的离子方程式为Na+2H2O==Na++2OH-+H2↑
D.①、②、③充分反应后所得溶液的质量分数从大到小的顺序为①>②>③
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、M、W在元素周期表中的相对位置如图,其中Z的核电荷数是Y 的两倍.下列说法正确的是
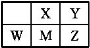
A.M位于元素周期表中第三周期ⅣA族
B.原子半径:Z>M>X
C.气态氢化物的热稳定性:Y>X>W
D.W的氧化物既能与NaOH反应,也能与HF反应,属于两性氧化物
难度: 中等查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是
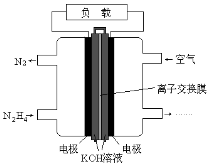
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极 表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
难度: 中等查看答案及解析
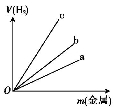
 (H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
(H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).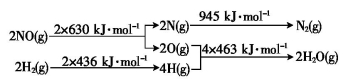
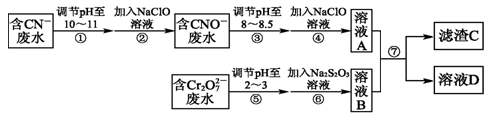

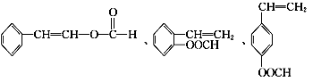 、_________、__________.
、_________、__________.