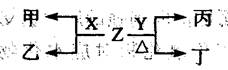-
下列说法正确的是( )
A.有化学键破坏的变化一定属于化学变化
B. 化学反应过程中,某离子被沉淀完全时,该离子在溶液中的浓度即为0
C.形成化学键吸收能量,破坏化学键释放能量
D.若化学平衡向正方向移动,则正反应速率一定增大
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.在同温同压下,相同体积的任何气体单质所含的原子数目相同
C.14 g乙烯和丙烯的混合物中总原子数为3NA个
D.含2molH2SO4的浓硫酸与足量的铜片在加热条件下反应,一定能产生NA个SO2气体分子
难度: 中等查看答案及解析
-
下列有关实验的叙述正确的是( )
A.在铜催化下,用加热的方法检验驾驶员是否酒后驾车
B.实验室中用水浴加热的方法制备乙酸乙酯
C.为便于观察和使用,将氯水、氨水、双氧水保存在棕色试剂瓶中
D.家庭中可用尿糖试纸检测尿液中的糖含量
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW
B. SO2通入碘水中,反应的离子方程式为SO2 + I2 + 2H2O = SO42- + 2I- + 4H+
C. 加入铝粉能产生H2的溶液中,可能存在大量的Na+ 、HCO3-、AlO2— 、NO3—
D. 100℃时,将 pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
难度: 中等查看答案及解析
-
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中加入溴水,溴单质被还原,由此可推断该溶液中 ( )
A.一定含有I-,不能确定是否有Cl— B.一定含有NO3-
C.不含有Fe3+ ,一定含有Cl— D.一定含有I一、NO3-和Cl—
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 金属单质与盐溶液的反应都是置换反应
B.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾难溶于水
C. 与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物
D.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
难度: 中等查看答案及解析
-
常温时,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
A.将0.2 mol•L-1的某一元酸HA溶液和0.1 mol•L-1 NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A一)=2c(H+)+c(HA)
B.某溶液中存在的离子有Cl-、OH-、NH4+、H+,则离子浓度不一定是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR一)=c(Na+)
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol•L-1,若a>7时,则该溶液的pH一定为14-a
难度: 中等查看答案及解析
-
下图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强
酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,
过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
下列有关平衡常数的说法正确的是( )
A.已知
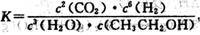 ,则对应的化学反应可以表示为:
,则对应的化学反应可以表示为:2CO2( g) + 6H2(g)
CH3CH2OH(g) + 3H2O(g)
B.将某浓度氢氟酸溶液升高温度,氢氟酸的电离平衡常数Ka将变大
C.常温下,向纯水中加入碳酸钠,水的电离程程度变大,Kw变大
D.化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变
难度: 中等查看答案及解析
-
某温度下,水的离子积常数K
。该温度下,将pH=4的
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1∶10 B.9∶1 C.1∶9 D.99∶21
难度: 中等查看答案及解析
-
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
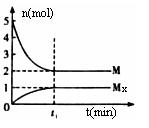
A.该反应的化学方程式是2HF
(HF)2
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
难度: 中等查看答案及解析
-
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )
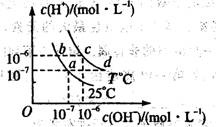
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42
B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3-
D.d点对应的溶液中大量存在:Na+、K+、SO32-、Cl—
难度: 中等查看答案及解析
-
下列有关化学方程式的叙述正确的是( )
A.已知2H2(g) + O2(g) === 2H2O(g) △H=-483.6kJ/mol,
则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨, s) === C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ HCl(aq) === NaCl(aq) + H2O(l) △H=-57.4kJ/mol
D.已知2C(s)+2O2(g) ===2CO2(g) △H1
2C(s)+ O2(g) ===2CO(g) △H2 则△H1>△H2
难度: 中等查看答案及解析
-
已知化学反应A2(g) + B2(g) === 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
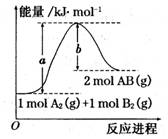
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ/mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出akJ能量
难度: 中等查看答案及解析
-
将足量的BaCO3分别加入:
①30mL水 ②10mL0.2mol/LNa2CO3溶液
③50m L0.01mol/LBaCl2溶液 ④100mL0.01mol/LHCl溶液
中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
A.①②③④ B. ③④①② C. ④①③② D. ②①④③
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5 mol/L,c(HI)=6 mol/L,则此温度下反应①的平衡常数为( )
A.49 B.16 C.36 D.42
难度: 中等查看答案及解析
-
霉酚酸(Mycophenolic acid)是一种生物活性化合物。下列有关霉酚酸的说法不正确的是( )
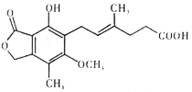
A. 分子式为:C17H20O6
B. 该物质能发生加成、取代、加聚等反应
C. 该物质能与FeCl3溶液发生显色反应
D. 一定条件下,1 mol霉酚酸最多可与2 mol NaOH反应
难度: 中等查看答案及解析
-
下列涉及有机物的性质或应用的说法不正确的是( )
A.干馏煤可以得到甲烷、苯和氨等重要化工原料
B.用于奥运“祥云”火炬的丙烷是一种清洁燃料
C.乙醇和乙酸都能发生氧化反应
D.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
难度: 中等查看答案及解析
-
阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是 ( )
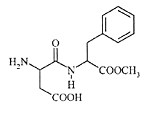
A.分子式为:C14H18N2O5,阿斯巴甜属于蛋白质
B.阿斯巴甜能与H2发生加成反应
C.阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D.阿斯巴甜在一定条件下能发生水解反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.标准状况下2.24L CO2通入1 mol•L-1100
氢氧化钠溶液中:CO2 + OH- = HCO3-
B.硝酸铝溶液中加入过量氨水:Al3-+ 4NH3·H2O = AlO2- + 4 NH4+ + 2H2O
C.Na2S水【解析】
S2-+ 2 H2OH2S + 2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应: NH4+ + HCO3- + 2OH- = CO32- + NH3↑+ 2H2O
难度: 中等查看答案及解析
-
下列化学原理表述正确的是 ( )
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多
C.NaHCO3溶液不显中性的原因:HCO3-+H2O
CO32-+H3O+
D.Na2CO3溶液中满足:2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
难度: 中等查看答案及解析
-
在一个可以加热的密闭容器中,加入Na2O2和NaHCO3各0.5mol,将容器加热至400℃,待充分反应后排出气体,则容器中剩余的固体是( )
A.Na2CO3 B.Na2CO3和Na2O2 C.NaOH D.Na2CO3和NaOH
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
化合物
A
B
C
D
Y
CO2
Fe2O3
C2H5OH
FeCl3
W
MgO
Al2O3
C2H5ONa
CuCl2
难度: 中等查看答案及解析
-
向某密闭容器中加入0.3molA, 0.1molC和一定量的B三种气体在一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~tl阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是 ( )
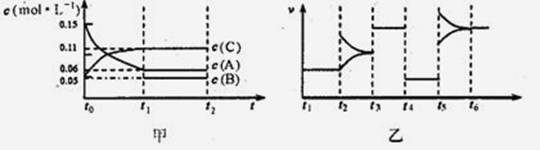
A.其他条件不变时,增大压强,B的转化率不变
B.t4~t5阶段改变的条件为降低温度
C.B的起始物质的量为0.02mol
D.若t5~t6阶段改变的条件为升高温度,则正反应为吸热反应
难度: 中等查看答案及解析