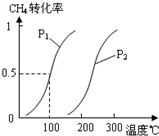
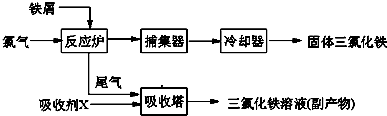
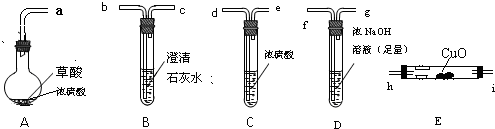
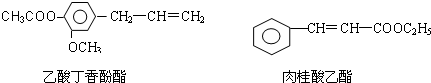-
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为4H++O2+4e-→2H2O难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数.下列叙述中正确的是( )
A.标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为NA
B.2 mol SO2和1 molO2 混合在V2O5存在条件下的密闭容器中反应,反应后分子总数大于2 NA
C.常温常压下,0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA
D.1 L 1 mol/L的K2CO3溶液中离子总数小于3NA难度: 中等查看答案及解析
-
下列表述中,不正确的是( )
A.用稀盐酸洗涤AgCl沉淀比用水洗涤,损耗AgCl少
B.等体积的pH均等于3的盐酸和AlCl3溶液中,已电离的水分子数前者一定小于后者
C.高效催化剂可使水分解,同时释放能量
D.明矾用于净水和氯气用于自来水的杀菌消毒,两个反应遵循的化学原理不同难度: 中等查看答案及解析
-
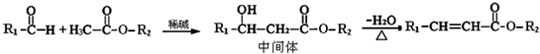
已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应:
下列说法正确的是( )
A.乙醇和乙醛能发生氧化反应,乙酸和乙酸乙酯则不能被氧化
B.上述①、②、③的反应类型分别是氧化反应、加成反应和取代反应
C.上述乙醇、乙酸和乙酸乙酯都具有同分异构体
D.工业上可以通过石油分馏的方法获得乙醇难度: 中等查看答案及解析
-
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量固体NaOH,溶液的pH会略微增大难度: 中等查看答案及解析
-
用石墨作电极电解+n价金属的硝酸盐溶液,当阴极上析出mg金属时,阳极上产生560mL(标准状况)气体,此金属的相对原子质量应为( )
A.10n
B.10m
C.10mn
D.40mn难度: 中等查看答案及解析
-
已知:常温下氢氟酸Ka=3.5×10-4,醋酸Ka=1.8×10-5,能正确描述在它们的钠盐溶液中,水电离出的c(H+)与盐浓度的关系曲线的是( )
A.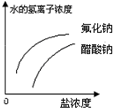
B.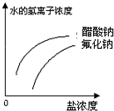
C.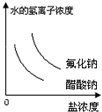
D.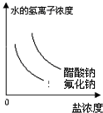
难度: 中等查看答案及解析