-
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液.
A.①
B.③
C.②③
D.①③④难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等难度: 中等查看答案及解析
-
大气中二氧化碳、甲烷和其他造成“温室效应”的气体大量排放,已使全球环境受到严重破坏.控制二氧化碳排放,需要从人人做起,“低碳生活”成为新的时尚潮流.下列不属于“低碳生活”方式的是( )
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机
B.尽量使用太阳能等代替化石燃料
C.减少使用一次性餐具
D.提倡塑料袋的无偿使用难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.SO2、Na2O2、活性炭都能使品红溶液褪色,但原理不同
B.摩尔是七个基本物理量之一
C.电解质溶于水时一定存在化学能与热能的相互转化
D.同温同压下,3 molC2H4(g)和1 mol CO(g)的密度相等难度: 中等查看答案及解析
-
下列各组离子在指定环境下能大量共存的是( )
A.pH=1的溶液中:Na+、S2-、K+、MnO4-
B.pH=7的溶液中:Al3+、Cl-、SO42-、HCO3-
C.pH=12的溶液中:Na+、AlO2-、SO42-、K+
D.pH=0的溶液中:Na+、K+、Fe2+、ClO-难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法中正确的是( )
A.常温下,100mL1mol/LNa2CO3溶液中阴离子总数大于0.1NA
B.1mol冰中含有的氢键数目为NA
C.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
D.分子数为NA的N2、C2H4混合气体体积约为22.4L,质量为28g难度: 中等查看答案及解析
-
利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、石蕊溶液
B.BaCl2、HCl、品红溶液
C.AgNO3和HNO3溶液
D.AgNO3和BaCl2溶液难度: 中等查看答案及解析
-
下列关于实验的叙述正确的是( )
A.向一定量的稀硫酸中加入除去油污的稍过量的废铁屑,是制备硫酸亚铁溶液的可行方案
B.向煮沸的1 mol•L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C.向铝屑与硫酸反应后的溶液中加入氢氧化钠溶液反应,是制备氢氧化铝的最佳方案
D.向某溶液中,依次加入氯水和硫氰化钾溶液,溶液变红,说明溶液中含有Fe2+难度: 中等查看答案及解析
-
下列物质反应后一定有+3价铁生成的是( )
①过量的Fe在Cl2中燃烧;
②Fe与过量稀H2SO4反应后,再向其中加KNO3;
③Fe(NO3)2溶液中加少量盐酸;
④Fe和Fe2O3的混合物溶于稀盐酸.
A.只有①②
B.只有②③
C.只有①②③
D.全部难度: 中等查看答案及解析
-
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未写全、未配平).NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色.据此判断下列说法一定合理的是( )
A.该反应中硫酸显示酸性和氧化性
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.每摩尔NH4CuSO3反应转移0.5 mol电子难度: 中等查看答案及解析
-
将15mL2mol/LNa2CO3溶液逐滴加入到20mL1.5mol/LMCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是( )
A.4
B.3
C.2
D.1难度: 中等查看答案及解析
-
有一不饱和的NaOH溶液,加入a molNa2O、b molNa2O2或c mol NaOH恰好得到NaOH饱和溶液(同一温度下),则a、b、c的关系为( )
A.a=b<
B.a=b>
C.a=b=
D.a>b>c难度: 中等查看答案及解析
-
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
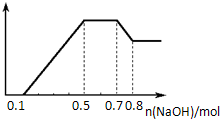
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.溶液中n(NH4+)=0.2mol
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+):n(Al3+):n(Mg2+)=1:1:1难度: 中等查看答案及解析
-
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是( )
A.参加反应的CO2的体积为0.224a L
B.用上述数据不能确定NaOH溶液的物质的量浓度
C.若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D.b可能等于a、小于a或大于a难度: 中等查看答案及解析
-
将4.9克Mg和Fe的混合物在一定量的稀HNO3溶液中完全溶解(溶液中有Fe2+),得到标准状况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量有可能是( )
A.6g
B.8g
C.10g
D.10.5g难度: 中等查看答案及解析