-
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分【解析】
2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:①称取过氧化钠固体2.00g;②把这些过氧化钠固体放入气密性良好的气体发生装置中;③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平;④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切;⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500ml、250ml、150ml的量筒备用,应选用量程为________的量筒
(2)该实验应选用________(填“酸式”或“碱式”)滴定管
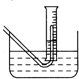
(3)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度________(填“偏高”“偏低”或“不变”);应进行的操作是________
(4)在步骤④中用到的仪器除了容量瓶外还需要________
(5)在步骤⑤中反应的离子方程式是________判定滴定达到终点的依据是________
(6)该过氧化钠的纯度为________(用百分数表示,保留一位小数;实验中得到的气体体积均看作为标准状况下)
-
Na2O2与水的反应实际是Na2O2 +2H2O═2NaOH+H2O 2,反应放热使部分H2O2受热分【解析】
2,反应放热使部分H2O2受热分【解析】
2H2O2═2H2O+O2↑。为了测定某过氧化钠固体的纯度,做如下实验(假设杂质不参加反应)
①称取过氧化钠固体2.00g
②把这些过氧化钠固体放入气密性良 好的气体发生装置中
好的气体发生装置中
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在112mL处恰好与水槽内液面相平
④将烧瓶中的液体转移到250mL的容量瓶中,洗涤并将洗涤液也转入容量瓶,然后加入蒸馏水,定容,使液面恰好与刻度相切
 ⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+ 存在)
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+ 存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为______的量筒。
(2)在步骤③测量气体体积时,必须待烧瓶和量筒内的气体都冷却到室温时进行,若此时量筒内的液面高于水槽中液面(如图),立即读数会使Na2O2的纯度______(填“偏高”“偏低”或“不变”);应进行的操作是 。

(3)在步骤⑤中反应的离子方程式是______判定滴定达到终点的依据是 。
(4)该过氧化钠的纯度为______。(保留一位小数;实验中得到的气体体积均看作为标准状况下)
-
在下列反应中,水仅作还原剂的是
A.Na2O+H2O=2NaOH B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.2K+2H2O=2KOH+H2↑
-
下列反应的离子方程式中正确的是
A.Na2O2与水反应:Na2O2 + H2O = 2Na+ + 2OH- + H2↑
B.FeSO4溶液与H2O2溶液混合:Fe2++H2O2+2H+═Fe3++2H2O
C.向Na2SiO3溶液中通入过量的SO2:SiO3 2- +SO2 +H2O = SO3 2- +H2SiO3↓
D.NH4 HCO3稀溶液与过量的Ca(OH)2溶液混合:NH4++HCO3-+2OH-+Ca2+═CaCO3↓+H2O+NH3·H2O
-
下列属于氧化还原反应的是( )
A.NH4Cl+NaOH  NH3↑+NaCl+H2O
NH3↑+NaCl+H2O
B.MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Na2O2+2H2O=2NaOH+H2O2
D.SO2+H2O=H2SO3
-
下列说法正确的是( )。
A.Na2O、Na2O2组成元素相同,但与CO2反应的产物不同
B.2Na2O2+2H2O==4NaOH+O2↑ Na2O2是氧化剂H2O是还原剂
C.Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O==2Na++2OH—十O2↑
D.Na2O2用作呼吸面具的供氧剂时氧元素即被氧化又被还原
-
下列说法正确的是
A.铝热剂属于电解质
B.氢氧化铁胶体属于纯净物
C.人造纤维、合成纤维和光导纤维都属于有机高分子化合物
D.Na2O2+2H2O=2NaOH+H2O2不属于氧化还原反应
-
下列说法正确的是
A.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同
B.2Na2O2+2H2O=4NaOH+O2↑, Na2O2是氧化剂,H2O是还原剂
C.Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O=2Na++2OH-+O2↑
D.Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原
-
下列说法正确的是( )
A.Na2O、Na2O2组成元素相同,且与CO2反应的产物相同
B.2Na2O2+2H2O 4NaOH+O2↑中Na2O2是氧化剂,H2O是还原剂
4NaOH+O2↑中Na2O2是氧化剂,H2O是还原剂
C.Na2O2溶于水产生O2的离子方程式为Na2O2+H2O 2Na++2OH-+O2↑
2Na++2OH-+O2↑
D.Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原
-
下列说法正确的是
A.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同
B.2Na2O2+2H2O=4NaOH+O2↑, Na2O2是氧化剂,H2O是还原剂
C.Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O=2Na++2OH-+O2↑
D.Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原

 ⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+ 存在)
⑤取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4 溶液去滴定,至终点时用去了24.20mLKMnO4 溶液(此时锰全部以Mn2+ 存在)